


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
| A、Ca2+、K+、CO32-、Cl- |
| B、K+、NH4+、HCO3-、OH- |
| C、H+、Fe2+、ClO-、SO42- |
| D、Na+、Ba2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
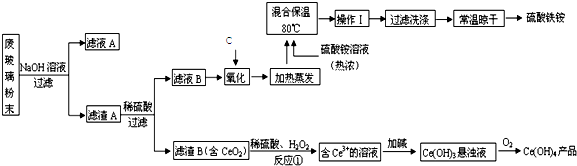
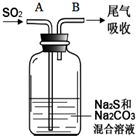 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途.| 资料:25℃时 | |
| H2CO3 | Ki1=4.4×10-7 |
| H2S | Ki1=1.3×10-7 |
| H2SO3 | Ki1=1.54×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
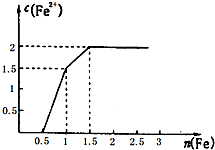 通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力.按要求回答下列问题.
通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力.按要求回答下列问题.| 元素编号/元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| X | 3.44 | 2.55 | 0.98 | 2.04 | 2.19 | 3.16 | 0.93 | 3.04 | 1.61 | |
| 常见化合价 | 最高价 | +4 | +1 | +3 | +1 | +3 | ||||
| 最低价 | -2 | -4 | -3 | -1 | -3 | |||||
| 物质/20℃时溶解度(g/100g溶剂) | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水中 | 216 | 9.02 | 1.9×10-14 | 35.8 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
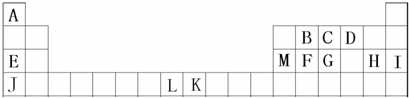
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
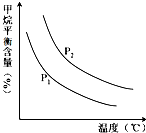 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子的最外电子层都有8个电子 |
| B、化学性质非常不活泼 |
| C、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| D、原子半径比同周期ⅦA族元素原子的小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com