
| A、原子的最外电子层都有8个电子 |
| B、化学性质非常不活泼 |
| C、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| D、原子半径比同周期ⅦA族元素原子的小 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
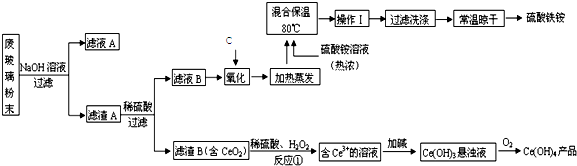
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比为2:1 |
| C、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷和丁烷互为同系物,化学性质相似 |
| B、丙烷和丁烷的特征反应均为取代反应 |
| C、C3H8没有同分异构体,C4H10有两种同分异构体 |
| D、等质量的丙烷和丁烷完全燃烧时,后者耗氧量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、当x≤
| ||
| B、当x≥n时,反应的离子方程式为:2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | ||
| C、当Fe2+和I-都被氧化时,x与n的关系为x>n | ||
| D、当x=n时,反应后氧化产物的物质的量为n mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(A2-)+c(OH-)=c(H2A)+c(H+) |
| B、c(HA-)>c(A2-)>c(H2A) |
| C、c(HA-)>c(H+)>c(OH-) |
| D、c(HA-)>c(OH-)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温时向20mL 0.1mol?L-1 HA溶液中不断滴入0.1mol?L-1 NaOH溶液,pH变化如图.下列叙述正确的是( )
常温时向20mL 0.1mol?L-1 HA溶液中不断滴入0.1mol?L-1 NaOH溶液,pH变化如图.下列叙述正确的是( )| A、HA的电离方程式:HA═H++A- |
| B、水的电离程度:a点>b点 |
| C、c点溶液:c(H+)+c(Na+)═c(A-)+c(HA) |
| D、d点溶液:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com