
| A、1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比为2:1 |
| C、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含氧原子数之比为1:3 |
| N |
| NA |
| V |
| 22.4 |
| N |
| NA |
| V |
| 22.4 |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
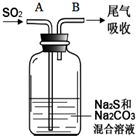 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途.| 资料:25℃时 | |
| H2CO3 | Ki1=4.4×10-7 |
| H2S | Ki1=1.3×10-7 |
| H2SO3 | Ki1=1.54×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
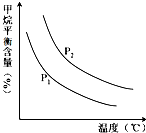 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Cu2+物质的量浓度 |
| B、C棒的质量 |
| C、Fe棒的质量 |
| D、Cl-物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
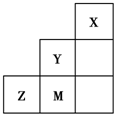 ??
??| A、非金属性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、Z元素最高价氧化物的对应水化物的浓溶液具有强氧化性和不挥发性 |
| D、三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子的最外电子层都有8个电子 |
| B、化学性质非常不活泼 |
| C、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| D、原子半径比同周期ⅦA族元素原子的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
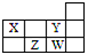 四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )| A、X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B、Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C、X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D、W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com