
【题目】用下图所示装置检验乙烯时不需要除杂的是( )

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
C | C2H5OH与浓H2SO4 | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4 | NaOH溶液 | Br2的CCl4溶液 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是 ( )
A. 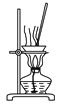 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 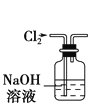 用图所示装置除去Cl2中含有的少量HCl
用图所示装置除去Cl2中含有的少量HCl
C. 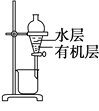 用图所示装置分离CCl4萃取碘水后已分层的有机层和水层
用图所示装置分离CCl4萃取碘水后已分层的有机层和水层
D. 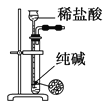 用图所示装置制取少量纯净的CO2气体
用图所示装置制取少量纯净的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示CH4+Cl2![]() CH3Cl+HCl中的相关微粒,其中错误的是
CH3Cl+HCl中的相关微粒,其中错误的是
A. 中子数为20的氯原子:![]()
B. Cl的结构示意图:![]()
C. CH4的比例模型: ![]()
D. HCl的电子式:H∶Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是

A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素 D. A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na、Mg、Al活动性顺序,某课外小组同学进行了如下实验:
实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中。 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液。 3.将一小段镁带投入稀盐酸中。 4.将一小片铝投入稀盐酸中。 |
他们记录的实验现象有:
实验现象 | ①剧烈反应,迅速生成大量的气体。 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红。 ③反应不剧烈,产生无色气体。 ④有气体产生,溶液变成红色。 |
请帮助该小组同学补充下列实验报告中的内容。
(1)在下表中填写与实验步骤相对应的实验现象序号。
实验步骤 | 1 | 2 | 3 | 4 |
实验现象 | _____ | _____ | _____ | _____ |
(2)写出镁与水反应的化学方程式: _____。
(3)实验结论是: Na、Mg、Al金属性逐渐_____。
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐_____,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此_____逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常常利用化学反应中的能量变化为人类服务。
⑴化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,既属于氧化还原反应,又属于放热反应的是_________。
A.Ba(OH)2·8H2O与NH4Cl混合搅拌 B.铝与氧化铁在高温下反应 C.铝与盐酸反应 D.NaOH与稀硫酸反应
②氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2kJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是_________。
A.Q1+Q2>Q3B.Q1+Q2<2Q3C. Q1+Q2<Q3D.Q1+Q2>2Q3
⑵电能是现代社会应用最广泛的能源之一。如下图所示的原电池装置中:
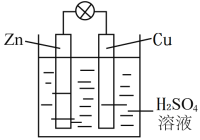
①负极材料是_______,正极上能够观察到的现象是_______________________,
②正极的电极反应式是______________。
③原电池工作一段时间后,若消耗锌6.5 g,则放出气体________L(标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是历史悠久、用量非常大的蓄电池,其构造图如图所示,放电时有PbSO4生成。
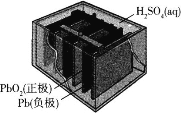
下列说法中错误的是
A.铅蓄电池是二次电池
B.放电时负极电极式:Pb-2e- +SO42-= PbSO4
C.充电时电解质溶液密度增大
D.当电路中转移电子数目为2NA时,溶液中SO42-减少或增加1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示的装置进行实验(实验条件下气体摩尔体积为Vm),实验开始前各活塞均关闭(两烧瓶容积相同)。

(1)同温同压下,两个烧瓶内HCl与NH3分子数目之比为_______,烧瓶Ⅱ中喷泉的颜色是____________。
(2)实验结束后烧瓶I中c(Cl- ) =_________molL-1。
(3)实验表明,若只是关闭b、打开a、c,则易在烧瓶I中观察到白烟,这表明气体分子扩散速率随着气体相对分子质量的增大而_____(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.2 mol NH3的质量为_____g,其中含有__个氨分子,氢原子的物质的量为______mol。
(2)质量相同的 CO2、NH3、SO2、O3 四种气体中,含有分子数目最多的是___________,在相同温度和相同压强条件下,体积最小的是____________。
(3)1.6g某气体含有 3.01×1022 个分子,该气体的摩尔质量为_________g/mol。
(4)把2.0 mol·L-1 Na2SO4溶液和1.0 mol·L-1 H2SO4 溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和),则SO![]() 的物质的量浓度为___________mol·L-1。
的物质的量浓度为___________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com