
【题目】下表列出了10种元素在元素周期表中的位置:
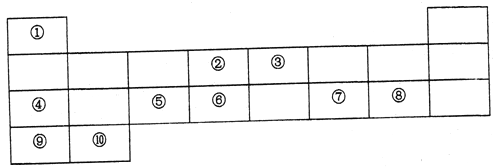
请用相应的化学用语回答下列问题:
(1)元素②在元素周期表中处于第_____周期,第______族。
(2)上述10种元素中,金属性最强的元素的符号为_________,最高价氧化物对应水化物中,酸性最强的物质的分子式为______,其中和Ar核外电子排布相同的离子的半径由大到小的顺序是为__________(用离子符号表示)。
(3)元素③的最高价氢化物的电子式为________,元素②和元素⑥的最简单氢化物中,稳定性较强的物质的结构式为______。用电子式表示⑦和⑨形成化合物的过程________。
(4)④在空气中燃烧的产物中所含化学键有________。
A.离子键 B.极性键 C.非极性键
(5)元素④、⑤、⑦的最高价氧化物对应水化物两两之间发生反应的离子方程式分别为____、_______、________。⑧的单质与⑩的最高价氧化物对应水化物反应的化学方程式为________。
【答案】 二 IVA K HClO4 S2->Cl->K+>Ca2+ ![]()
![]() AC Al(OH)3+3H+=Al3++3H2O H++OH-=H2O Al(OH)3+OH-=AlO2-+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
AC Al(OH)3+3H+=Al3++3H2O H++OH-=H2O Al(OH)3+OH-=AlO2-+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】根据元素在周期表中的位置,首先判断出元素种类。然后依据元素周期律和相关物质的性质解答。
根据10种元素在元素周期表中的位置可判断它们分别是H、C、N、Na、Al、Si、S、Cl、K、Ca,则
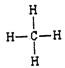
(1)碳元素在元素周期表中处于第二周期、第 IVA族。(2)同周期自左向右金属性逐渐减弱,同主族自上而下金属性逐渐增强,则上述10种元素中,金属性最强的元素的符号为K;氯元素的非金属性最强,则最高价氧化物对应水化物中,酸性最强的物质的分子式为HClO4;核外电子排布相同的离子,其离子半径随原子序数的增大而减小,因此其中和Ar核外电子排布相同的离子的半径由大到小的顺序是为S2->Cl->K+>Ca2+。(3)元素③的最高价氢化物是氨气,含有共价键,电子式为![]() ;同主族自上而下非金属性逐渐减弱,元素②和元素⑥的最简单氢化物中,稳定性较强的物质是甲烷,结构式为
;同主族自上而下非金属性逐渐减弱,元素②和元素⑥的最简单氢化物中,稳定性较强的物质是甲烷,结构式为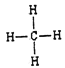 。⑦和⑨形成化合物是硫化钾,含有离子键,其形成的过程可表示为
。⑦和⑨形成化合物是硫化钾,含有离子键,其形成的过程可表示为![]() 。(4)钠在空气中燃烧的产物是过氧化钠,其中所含化学键有离子键、非极性键,答案选AC。(5)元素④、⑤、⑦的最高价氧化物对应水化物分别是氢氧化钠、氢氧化铝和硫酸,两两之间发生反应的离子方程式分别为Al(OH)3+3H+=Al3++3H2O、H++OH-=H2O、Al(OH)3+OH-=AlO2-+2H2O。氯气与氢氧化钙溶液反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
。(4)钠在空气中燃烧的产物是过氧化钠,其中所含化学键有离子键、非极性键,答案选AC。(5)元素④、⑤、⑦的最高价氧化物对应水化物分别是氢氧化钠、氢氧化铝和硫酸,两两之间发生反应的离子方程式分别为Al(OH)3+3H+=Al3++3H2O、H++OH-=H2O、Al(OH)3+OH-=AlO2-+2H2O。氯气与氢氧化钙溶液反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


科目:高中化学 来源: 题型:
【题目】在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于
A. 只存在于氧气中 B. 只存在于SO3中
C. 只存在于SO2和SO3中 D. SO2、SO3、O2中都存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温条件下,Al和Fe3O4反应生成Fe和Al2O3。下列说法正确的是

A. 该反应过程中的能量变化如图所示
B. 该反应条件下,Al的还原性弱于Fe
C. 1molFe3O4参与反应转移8×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的碱性溶液中能大量共存的离子组是
A.K+ 、Cu2+、Na+、Cl-
B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-
D.Fe3+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.欲提高氯水中HClO的浓度可往氯水加适量的碳酸钙粉末
B.形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的化学方程式为_________________。
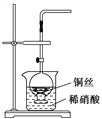
图甲
(2)NO是有毒气体。某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝
C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
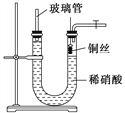
图乙
①长玻璃管的作用是______________________________________________。
②让反应停止的操作方法及原因是________________________________。
以下收集NO气体的装置,合理的是________(填选项代号)。
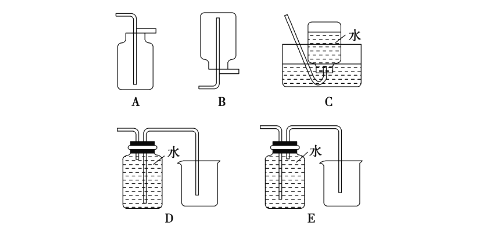
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。
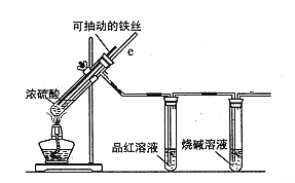
(1)写出铁与浓硫酸反应的化学方程式 ;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)品红溶液的作用是 。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com