


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������ܹ����еĻ�ѧ��Ӧ���Ƿ��ȷ�Ӧ�������½��еķ�Ӧ�������ȷ�Ӧ |
| B�����³�ѹ�£�pH = 1��������Լ����6.02��1023�������� |
| C�����³�ѹ�£�0.5mol�����������Ļ�������������11.2L |
| D��ԭ���װ�õ���������������ͬһ�ֽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ����ȷ����
����ȷ����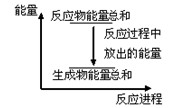

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)��D(g)���仯ѧƽ�ⳣ��K���¶ȱ仯�Ĺ�ϵ���±���ʾ���������й��ж���ȷ����
C(g)��D(g)���仯ѧƽ�ⳣ��K���¶ȱ仯�Ĺ�ϵ���±���ʾ���������й��ж���ȷ����| T/�� | 800 | 850 | 1 000 | 1 200 |
| K | 0��9 | 1��0 | 1��7 | 2��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������Ƿ������绹�dz�ϫ���磬���ǽ���ѧ��ת��Ϊ���� |
| B����ϡ��Һ��������ͼ�����кͷ�Ӧ�ķ�Ӧ����ֵ����� |
| C����ѧ��Ӧ�ķ�Ӧ��ֻ�뷴Ӧ��ϵ��ʼ̬����̬�йأ����뷴Ӧ��;���� |
| D����ͼ�������ڵķ�Ӧ��ϵ����ʹ�ô�����E1���С��������������ϵ���¶ȣ�E1������ |
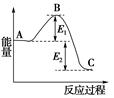
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮ�м�������ʹˮ�ĵ���ƽ�������ƶ���ˮ�����ӻ����� |
| B��NH3(g)��HCl(g)==NH4Cl(s)��H��0������һ���¶��Է�������һ���¶ȷ��Է� |
| C��Ǧ�����ڷŵ�����У������������٣������������� |
| D���ñ���Na2CO3��Һ����BaSO4�������ɽ�BaSO4ת��ΪBaCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͭ�����ܽ� |
| B����װ���ܽ�����ת��Ϊ��ѧ�� |
| C������������ͨ����������ͭ�� |
| D��������ӦΪFe-2e-=Fe2+ |
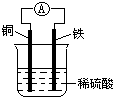
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڴ��������װ��ͭ��ɷ�ֹ�䷢���绯ѧ��ʴ |
| B��MnO2��FeCl3��CuSO4���ɼӿ�H2O2�ķֽ����� |
| C��FeCl3��Һ��Fe2(SO4)3��Һ�������ɡ����ն��õ�Fe2O3 |
| D���ö��Ե缫�ֱ���CuCl2��Һ��MgCl2��Һ�ֱ�õ�����Cu��Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ⶨHCl��NaOH���к���ʱ��ÿ��ʵ���Ӧ���������¶ȣ���������ʼ�¶ȡ�NaOH��ʼ�¶Ⱥͷ�Ӧ�����ֹ�¶� |
| B���ɡ�C��ʯī��=C�����ʯ������H=" +119" kJ/mol ����֪���ʯ��ʯī�ȶ� |
| C����ϡ��Һ�У� H+��OH����H2O����H����57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molNaOH����Һ��ϣ��ų�����������57.3kJ |
| D����101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l)����H= +285.8kJ/mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com