
【题目】下列化学工艺不可行的是( )
A.N2![]() NO
NO![]() NO2
NO2 ![]() HNO3
HNO3
B.石英砂![]() 粗硅
粗硅![]() 粗SiCl4
粗SiCl4![]() 高纯硅
高纯硅
C.提取食盐后的母液![]() 含Br2的溶液
含Br2的溶液![]() …
…![]() 粗Br2
粗Br2![]() Br2
Br2
D.铝土矿![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
【答案】C
【解析】
A. 工业上,利用氮气与氢气在高温高压催化剂的条件下合成氨气,氨气与氧气发生反应生成一氧化氮,再进行后续的反应,A项可行;
B. 工业上制高纯硅的流程,SiO2+2C![]() Si(粗)+2CO↑,Si+2Cl2
Si(粗)+2CO↑,Si+2Cl2![]() SiCl4,SiCl4+H2
SiCl4,SiCl4+H2![]() Si(纯)+3HCl,B项可行;
Si(纯)+3HCl,B项可行;
C. 母液含溴离子,与氯气反应生成溴,热空气吹出后,应先被二氧化硫吸收后氯气与HBr反应生成粗溴,最后蒸馏分离出溴,C项不可行;
D. 工业上用铝土矿制铝的过程,每一步所加试剂必须过量,铝土矿(主要成分含氧化铝)加入氢氧化钠,发生反应:Al2O3+2NaOH═2NaAlO2+H2O,偏铝酸钠溶液通入过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3,煅烧氢氧化铝生成氧化铝,再电解熔融氧化铝得到金属铝,D项可行;
答案选C。


科目:高中化学 来源: 题型:
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是
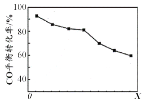
A . 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某HCl溶液的物质的量浓度,可用0.1000mol·L-1NaOH标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
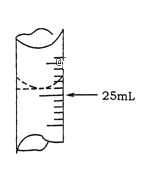
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ___________;
(2)乙学生做了三组平行实验,数据记录如下:
实验 序号 | 待测HCl溶液的体积/mL | 0.1000mol·L-1NaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出HCl待测溶液的物质的量浓度为 ________mol·L-1(小数点后保留四位);
(3)滴定时的正确操作是_____________________________________________________。滴定达到终点的现象是_____________________________________________;此时锥形瓶内溶液的pH的范围是________。
(4)下列哪些操作会使测定结果偏高_______________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.

1)写出该反应的方程式:__________________
2)计算该温度下该反应的平衡常数:____________
3)已知:K(300℃)<K(350℃),该反应是__________热反应.
4)0~4分钟时,B的平均反应速率为:____________
5)到达平衡时A的转化率为:____________
6)恒容条件下,下列措施中能使n(A)/n(C)降低的有____________.
A.充入氦气 B.使用催化剂
C.再充入2.4molA和1.6molB D.降低温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是( )
A.该温度下,0.31 mol·L-1的HF溶液的pH=2
B.升高温度或增大浓度,HF的电离平衡常数都将增大
C.两溶液混合不会产生沉淀
D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验及其分析叙述正确的是( )
A.向2.0mL浓度均为0.lmolL-l的KC1、KI混合溶液中滴加1~2滴0.0lmol/LAgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入适量的H2O2,铜粉仍不溶解
C.向AlC13溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀不消失
D.将CO2通入Ba(NO3)2溶液中至饱和,无沉淀产生;再通入SO2,也无沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中﹣lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
(已知:Ksp(ZnS)=3×10﹣25mol2/L2)

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=10﹣35.4mol2/L2
D. 向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:____________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=________,b=________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
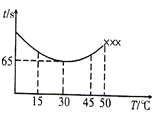
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:____。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二:_________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定):____。
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。实验时按如下步骤操作:

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数。
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_______________________;装置②的作用是_________________________
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为_______________________________________________________。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是____________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是___________(写一种即可)。
(5)某人设想以右图所示装置用电化学原理生产硫酸, 写出通入SO2的电极的电极反应式___________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com