
����Ŀ����������Ϊһ�����ʹ��ܵ�أ���Ӧ���õ����Ӻͷ�չ��
��1��Al��NO3��3���Ʊ������ز�����ԭ��֮һ������Al��NO3��3�������ջ����е�ˮ�֣������Ҫ������ж������������岽����ͼ��ʾ�� 
�ټ��������ˮ������Ӧ�����ӷ���ʽΪ�� ��
�ڲ���bΪ��
��Al��NO3��3����Һ�У�c��Al3+��=mol/L���ú�m��V�Ĵ���ʽ��ʾ����
��2�������������ڽ����ơ�������Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ1��ʾ�� 
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050�� |
�е�/�� | 892 | 444.6 | 2980 |
�ٸ��ݱ����ݣ������жϸõ�ع���������Ӧ������������ĸ����Χ�ڣ�
A.100������ B.100��300��C.300��350��D.350��2050��
�ڷŵ�ʱ���缫AΪ�����缫B������Ӧ���������ԭ����
�۳��ʱ���ܷ�ӦΪNa2SX�T2Na+xS��3��x��5�����������ĵ缫��ӦʽΪ�� ��
��3��������������Ϊ��Դ��������װ��KI��������Һ��ͼ2��ʾ�����ڵ��м��������ӽ���Ĥ������ͨ��һ��ʱ����������Һ����ɫ��һ��ʱ�����ɫ��dz�����Ҳ���ĵ缫����ʽ�����Է��������Һ��ɫ��dz�Ŀ���ԭ���ǣ� ��
���𰸡�
��1��Al3++3NH3?H2O�TAl��OH��3��+3NH4+�����ˣ�![]()
��2��C��������ԭ��Sx2����2e���TxS
��3��2H2O+2e��=H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ
���������⣺��1�����ɲ������̿�֪ʵ��ԭ����Al��NO3��3�Ͱ�ˮ��Ӧ����Al��OH��3 �� �Լ�aΪ��ˮ����Ӧ�ķ���ʽΪAl3++3NH3H2O�TAl��OH��3��+3NH4+ �� ���Դ��ǣ�Al3++3NH3H2O�TAl��OH��3��+3NH4+�����ɲ������̿�֪ʵ��ԭ����Al��NO3��3�Ͱ�ˮ��Ӧ����Al��OH��3 �� �����˵õ�Al��OH��3���壬���Բ���bΪ���ˣ����Դ��ǣ����ˣ���n��Al2O3��= ![]() =
= ![]() mol����n��Al��NO3��3��=2n��Al2O3��=
mol����n��Al��NO3��3��=2n��Al2O3��= ![]() mol�� c��Al��NO3��3��=
mol�� c��Al��NO3��3��= ![]() =
= ![]() mol/L�����Դ��ǣ�
mol/L�����Դ��ǣ� ![]() ����2����ԭ��ع���ʱ�����Ƶ��¶�ӦΪ����Na��SΪ����״̬�����¶�Ӧ����115�������444.6�棬ֻ��C���ϣ����Դ��ǣ�C���ڷŵ�ʱ��Na����������AӦΪԭ��ظ�����BΪ����������ԭ��Ӧ�����Դ��ǣ�������ԭ���۳��ʱ���ǵ��ط�Ӧ��������ӦΪ��Sx2����2e��=xS�����Դ��ǣ�Sx2����2e���TxS����3���������Ϸ����������Һ����ɫ������I2 �� ���缫Ϊ�������缫��ӦΪ��2I����2e��=I2 �� �Ҳ�缫Ϊ�������缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� �Ҳ�I����OH��ͨ�������ӽ���Ĥ������ƶ���������Ӧ3I2+6OH��=IO3��+5I��+3H2O��һ��ʱ�����ɫ��dz�����Դ��ǣ�2H2O+2e��= H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ��
����2����ԭ��ع���ʱ�����Ƶ��¶�ӦΪ����Na��SΪ����״̬�����¶�Ӧ����115�������444.6�棬ֻ��C���ϣ����Դ��ǣ�C���ڷŵ�ʱ��Na����������AӦΪԭ��ظ�����BΪ����������ԭ��Ӧ�����Դ��ǣ�������ԭ���۳��ʱ���ǵ��ط�Ӧ��������ӦΪ��Sx2����2e��=xS�����Դ��ǣ�Sx2����2e���TxS����3���������Ϸ����������Һ����ɫ������I2 �� ���缫Ϊ�������缫��ӦΪ��2I����2e��=I2 �� �Ҳ�缫Ϊ�������缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� �Ҳ�I����OH��ͨ�������ӽ���Ĥ������ƶ���������Ӧ3I2+6OH��=IO3��+5I��+3H2O��һ��ʱ�����ɫ��dz�����Դ��ǣ�2H2O+2e��= H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬��1���ֻ����1���Br2�����ӳɷ�Ӧ����������飬�������1 mol����4 mol Cl2������ȫȡ����Ӧ��������Ľṹ��ʽΪ(����)
A. CH2=CH2B. CH3CH=CH2C. CH3CH3D. CH2=CHCH=CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ȷ�Ӧ�ڳ����¶���������
B.���ȷ�Ӧ�����ȾͲ��ᷢ��
C.��Ҫ���Ȳ��ܷ����ķ�Ӧ�������ȷ�Ӧ
D.���ݷ�Ӧ����������������������Դ�С��ȷ����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ɢϵ�ͽ����˵����ȷ���� �� ��
A.���塢��Һ����Һ���Ƿ�ɢϵB.���ӵİ뾶����Һ����Һ������
C.�ɼ���ͨ����Һʱ���������������D.���嶼���������ȶ��Լ�ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ������������Դ��һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2 ��g��CH3OH��g����H=a kJmol��1 �� �����Ϊ2L���ܱ������г���2mol CO��4mol H2 �� ��ò�ͬ�¶������������������ʵ�����ʱ�䣨min���ı仯��ϵ��ͼ�Т�������ʾ�� 
��1�����жϷ�Ӧ�ﵽ��ѧƽ��״̬����������ĸ����
A.c��CO����c��H2���ı�ֵ���ֲ���
B.����������ѹǿ���ֲ���
C.�����������ܶȱ��ֲ���
D.��λʱ������1molCO���ĵ�ͬʱ��1mol CH3OH����
E.v����H2��=2v����CH3OH��
��2���٢�͢���ȣ���ı�ķ�Ӧ������ ��
�ڷ�Ӧ����9minʱ�ﵽƽ�⣬�ȽϷ�Ӧ����¶ȣ�T1���ͷ�Ӧ����¶ȣ�T3���ĸߵͣ�T1T3���������������=������������Ӧ����Ӧ������Ȼ����ȡ�����
��3���ٷ�Ӧ����6minʱ�ﵽƽ�⣬�ӷ�Ӧ��ʼ���ﵽƽ��ʱv ��CH3OH��=mol/��Lmin����
�ڷ�Ӧ����2minʱ�ﵽƽ�⣬������¶��µ�ƽ�ⳣ��K= �� ��������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1mol CO��3mol CH3OH��ƽ�⽫���������Ӧ���淴Ӧ�Ͳ��ƶ�������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ����ԭ���ԭ���ǵ绯ѧ��������Ҫ���ݣ�ij��ȤС������ͼ̽��ʵ�飺
��1����ͼ1Ϊijʵ��С������������ԭ��Ӧ��Ƶ�ԭ���װ�ã���������װ�б��͵�KNO3��Һ�������ƳɵĽ�������NO3������װ�ã���д�����ҡ����������������䣬����CuCl2��Һ��ΪNH4Cl��Һ������������ɫ��ζ�ĵ������壬��ʯī�ϵ缫��Ӧʽ �� 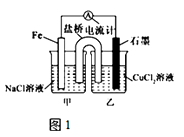
��2����ͼ2�������������䣬�������Ż�����ͭ������ʯī������n�ͣ����װ�������ԭ��ػ���ء�������װ����ʯī��2��Ϊ������װ����������������ʯī��1���缫�Ϸ����ķ�ӦʽΪ �� 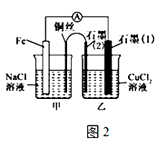
��3����ͼ2��װ���и�Ϊ����CuSO4��Һ��һ��ʱ�����ijһ�缫�������� 1.28g������һ�缫����mL������£����壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨijþ���Ͻ���þ������������ijС���ȡ�úϽ�9.0g������ϡ���ᷴӦ������������������Ϊ10.08L����״����������þ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ص�����������Ϊ2���۵�����Ϊ5��������ͬ����ԭ��������С��Ԫ�أ����ڸ�Ԫ�ص��жϴ�����ǣ� ��
A.�����Ų�ʽΪ1s22s22p63s23p63d34s2
B.��Ԫ��ΪV
C.��Ԫ��Ϊ��A��Ԫ��
D.��Ԫ��λ��d��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com