
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)![]() 3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
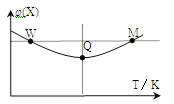
下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系![]() 其他产物略去
其他产物略去![]() ,
,
![]()
下列判断正确的是![]()
A.若图中反应均为非氧化还原反应,W为![]() ,则X可能是
,则X可能是![]()
B.若图中反应均为氧化还原反应,W为![]() ,则Z可能是
,则Z可能是![]()
C.若图中反应均为非氧化还原反应,W为NaOH,则Y可能是![]()
D.若图中反应均为氧化还原反应,W为![]() ,则X可能是
,则X可能是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)取一定量胆矾(CuSO4·5H2O)溶于水,再滴几滴稀硫酸,充分搅拌后得到一定体积的CuSO4溶液。向其中加适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)用无水乙醇洗涤的目的是________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
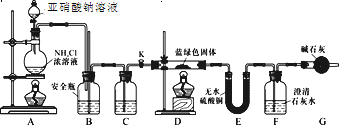
(2)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生的N2将装置中的空气排除,避免干扰。C中盛装的试剂应是________。
(3)装置A中发生反应的离子方程式为________。
(4)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是________。
(5)同学们查阅文献知:Ksp(CaCO3)=2.8×10-9,Ksp(BaCO3)=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是________。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是________。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为![]() 恒容密闭容器中发生反应:
恒容密闭容器中发生反应:
![]()
下列说法正确的是![]()
窗口编号 | 温度 | 起始物质的量 | 平衡物质的量 | |
|
|
| ||
1 | 380 |
|
|
|
2 | 380 |
| ||
3 | 230 |
|
|
|
A.该反应的正反应为放热反应
B.达到平衡时,容器1中的![]() 体积分数比容器2中的小
体积分数比容器2中的小
C.容器1中反应达到平衡所需的时间比容器3中的长
D.若起始时向容器Ⅲ中充入![]()
![]()
![]() 、
、![]()
![]()
![]() 和
和![]()
![]() ,则反应向逆反应方向进行
,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·eH2O]在一定条件下的转化如下图所示,下列说法不正确的是

A. Q可能为NH3B. a、b、c、d符合关系式:2a+3b=c+2d
C. X可能为NaOHD. 碱式碳酸铝镁医疗上可用做抗酸剂,工业上可用做阻燃剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个固定容积均为1L密闭容器中以不同的氢碳比![]() 充入
充入![]() 和
和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]()
![]() 的平衡转化率
的平衡转化率![]() 与温度的关系如图所示.下列说法正确的是
与温度的关系如图所示.下列说法正确的是![]()
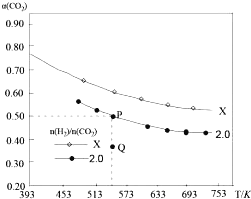
A.该反应在高温下自发进行
B.X的氢碳比![]() ,且Q点在氢碳比为
,且Q点在氢碳比为![]() 时
时![]()
C.若起始时,![]() 、
、![]() 浓度分别为
浓度分别为![]() 和
和![]() ,则可得到P点,对应温度的平衡常数的值为512
,则可得到P点,对应温度的平衡常数的值为512
D.向处于P点状态的容器中,按2:4:1:4的比例再充入![]() 、
、![]() 、
、![]() 、
、![]() ,再次平衡后
,再次平衡后![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20g烧碱配制成500mL溶液。
(1)所得溶液的物质的量浓度为多少?(写出计算过程,下同)
(2)从中取出lmL,将其用水稀释到l00mL,所得溶液中溶质的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A.加热水至100℃[其中c(H+)=1×10-6mol·L-1]B.向水中加入NaHSO4
C.向水中加入Cu(NO3)2D.在水中加入Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
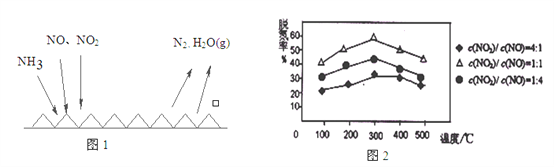
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com