


科目:高中化学 来源: 题型:
| 1 | 8 |
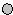 和○代表两种不同的粒子.E与D形成的化合物的晶胞是下列中的
和○代表两种不同的粒子.E与D形成的化合物的晶胞是下列中的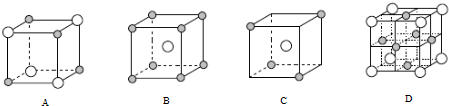
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省菏泽市高三3月模拟(一模)考试理综化学试卷(解析版) 题型:填空题
已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大, A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1。请回答下列问题:
(1)C原子基态时的电子排布式为?????????????? 。?
(2)B、C两种元素第一电离能为:????? ﹥ ???????? (用元素符号表示)。
试解释其原因: ??????????????????????????????????????????????????????? 。
(3)任写一种与AB- 离子互为等电子体的微粒????????????????????????????????? 。
(4)B与C形成的四原子阴离子的立体构型为??????????? ,其中B原子的杂化类型是???????? 。
(5)D和E形成的化合物的晶胞结构如图,其化学式为???????? ,E的配位数是??????????????? ;已知晶体的密度为? ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长a=??????????? cm.(用含 、NA的计算式表示)
、NA的计算式表示)

查看答案和解析>>
科目:高中化学 来源:2013-2014学年内蒙古鄂尔多斯市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题。
(1)C原子基态时电子排布式为 。
(2)B、C两种元素第一电离能为 > (用元素符号表示)。试解释其原因: 。
(3)任写一种与AB-离子互为等电子体的离子 。
(4)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ;∠EDE= ;E的配位数是 ;已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm。(用ρ、NA的计算式表示)

查看答案和解析>>
科目:高中化学 来源:2014届四川省绵阳市高二12月月考化学试卷(解析版) 题型:填空题
已知元素A、B、C、D和E的原子序数依次增大。A、B、C、D四种元素核电荷数均小于20,A、B同主族;B、C、D元素的基态原子具有相同的能层数,它们的基态原子中p能级上未成对电子数分别为1、3、1;E是周期表中(除放射性元素外)第一电离能最小的元素。回答下列问题:
(1)写出下列元素的符号:A 、E 。
(2)C元素的价电子排布图为: ;
该排布遵循的原理主要有: (答完整得分)。
(3)C、D元素形成的化合物主要有: (填化学式,答完整得分);其中相对分子质量较小的分子为 分子(填“极性”或“非极性”),该分子的空间构型为 ,中心原子的杂化方式是 。
(4)化合物BD3的熔点190℃、沸点182.7℃,那么BD3的晶体类型为 ;事实上,在BD3的化合物中往往以B2D6的形式存在,该形式的存在是由于 形成的。(选填“氢键”、“范德华力”、“离子键”、“配位键”)
(5)下图为几种晶胞(或晶胞的1/8)示意图,其中 和
和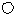 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com