
【题目】已知水在25℃和100℃时,其电离平衡曲线如下图所示:

(1)25℃时,水的离子积为_________________
(2)若向25℃的水中滴加少量冰醋酸,c(H+)_____________(填“变大”、“变小”或“不变”),醋酸的电离方程式为________________________
(3)若向100℃的水中加入少量Ag2CrO4固体,一段时间后,达到Ag2CrO4的沉淀溶解平衡,该温度下溶度积的表达式Ksp (Ag2CrO4)=_____。
【答案】1.0×10-14 变大 CH3COOH![]() CH3COO-+H+ c2(Ag+)·c(CrO42-)
CH3COO-+H+ c2(Ag+)·c(CrO42-)
【解析】
(1)根据水的电离平衡可知,水电离产生的c(H+)= c(OH—),所以在25℃的曲线上,c(H+)= c(OH—)= 1.0×10-7mol/L,则水的离子积Kw= c(H+)×c(OH—)= 1.0×10-14;
(2)冰醋酸溶于水发生部分电离,生成的H+使溶液中的c(H+)增大;其电离方程式为CH3COOH![]() CH3COO— + H+;
CH3COO— + H+;
(3)由Ag2CrO4的沉淀溶解平衡Ag2CrO4(s)![]() 2Ag++CrO42-可得,Ksp (Ag2CrO4)= c2(Ag+)·c(CrO42-)。
2Ag++CrO42-可得,Ksp (Ag2CrO4)= c2(Ag+)·c(CrO42-)。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】合成氨反应N2(g)+3H2(g)![]() 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。

请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变________(填“大”或“小”),E的大小对该反应的反应热有无影响?_______。理由是____________________________;
(2)图中ΔH=______kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2 ,经过50 min,NH3的浓度为1mol·L-1,则v(N2)=_________mol·L-1·min-1、c(H2)=___________mol·L-1;
(4)已知NH3(g)=== NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)===2NH3 (l)的热化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸冬青油、阿司匹林的结构简式如图,下列说法不正确的是

A. 由水杨酸制冬青油的反应是取代反应
B. 阿司匹林的分子式为C9H8O4,在一定条件下水解可得水杨酸
C. 冬青油苯环上的一氯取代物有4种
D. 可用NaOH溶液除去冬青油中少量的水杨酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。ΔH
CH3OH(g)。ΔH
(1)平衡常数表达式为K=_______。
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。

① 该反应的焓变ΔH________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是_______。
a. 升高温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G、Q、X、Y、Z均为含氯的化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):①G→Q+NaCl;②Q+H2O![]() X+H2;③Y+NaOH→G+Q+H2O;④Z+NaOH→Q+X+H2O。这五种化合物中氯元素的化合价由低到高的顺序为( )
X+H2;③Y+NaOH→G+Q+H2O;④Z+NaOH→Q+X+H2O。这五种化合物中氯元素的化合价由低到高的顺序为( )
A.GQZYXB.GYQZX
C.GYZQXD.ZXGYQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是
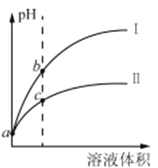
A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )

A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. 曲线①的c点和曲线②的c点所代表的溶液酸碱性相同
D. a、d两点对应的溶液均显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com