
某元素原子最外层上只有两个电子,该元素()
A. 一定是金属元素
B. 一定是ⅡA族元素
C. 一定是过渡元素
D. 可能是金属元素,也可能不是金属元素
考点: 原子结构与元素周期律的关系;位置结构性质的相互关系应用.
专题: 元素周期律与元素周期表专题.
分析: 某元素原子最外层上只有两个电子,可能为稀有气体He,也可能为第ⅡA族元素,如Mg,还有可能为副族元素,以此来解答.
解答: 解:某元素原子最外层上只有两个电子,可能为稀有气体He,也可能为第ⅡA族元素,如Mg,还有可能为副族元素,
A.可能为金属元素,故A错误;
B.可能为第ⅡA族元素,故B错误;
C.可能为过渡元素(包括副族元素和第ⅤⅢ族元素),故C错误;
D.可能是金属元素,也可能为非金属元素,故D正确;
故选D.
点评: 本题考查原子结构与元素在周期表中的位置,明确最外层电子数为2的元素有多种可能是解答本题的关键,难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g) CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
t/s 0 500 1 000
c(H2)/(mol•L﹣1) 5.00 3.52 2.48
c (CO)/(mol•L﹣1) 2.50
1.76
1.24
(1)在500s内用H2表示的化学反应速率是
(2)在1 000s内用CO表示的化学反应速率是,1 000s时CO的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是.
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)()
A. 
用装置甲检验溶液中是否有K+
B. 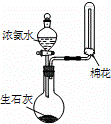
用装置乙制取并收集少量NH3
C. 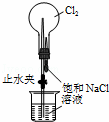
用装置丙进行喷泉实验
D. 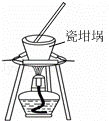
用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
硝铝[Al(NO3)3]是一种常用媒染剂.工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3•9H2O]的流程如图甲:
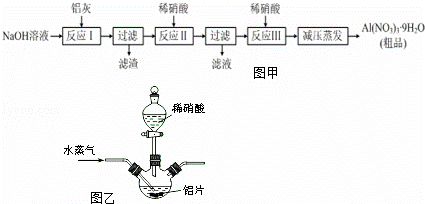
(1)写出反应Ⅰ的离子方程式: )(任写一个).
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是),可采取的措施为
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是.
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是.
(5)若用图乙所示实验装置制取Al(NO3)3,通入水蒸气的作用是.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是一套实验室制气装置,用于发生、干燥和收集气体. 下列各组物质中能利用这套装置进行实验的是()

A. 铜屑和浓硝酸 B. 二氧化锰和浓盐酸
C. 锌和稀硫酸 D. 碳酸钙和稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A+3B═2C+2D在四种不同的情况下的反应速率如下,最快的是()
A. v(A)=0.15mol/(L•min) B. v(B)=0.6mol/(L•min)
C. v(c)=0.4mol/(L•min) D. v(D)=0.45mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
当铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率增大的是()
A. 不用稀硫酸,改用98%的浓硫酸
B. 加热
C. 适当增大稀硫酸的浓度
D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
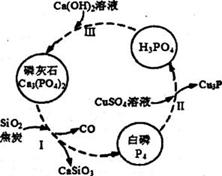
氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)1个NH4+的电子数为_______个,沸点PH3_______NH3(填大于、小于或等于)。
(2)NaNO2有毒,与食醋共熟会生成两种中学常见的氮氧化物气体,该反应的离子方程式为__________________________________________
(3)磷及部分重要化合物的相互转化关系如下图所示。
①白磷(P4)的晶体类型为____________________。
②步骤I是白磷(P4)的工业生产方法。反应在高温条件下进行,其中SiO2的作用是用于造渣
(CaSiO3),焦炭的作用是作______________。 (填氧化剂或还原剂)
③不慎将自磷(P4)沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4
所能氧化的自磷(P4)的物质的量为___________
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5(PO4)3OH(ksp=6.8×10﹣37)。人们常使用舍氟离子的牙膏防蛀牙,其中的氟化物可使羟基磷灰石转化为氟磷灰石Ca5(PO4)3F(Ksp=1.0×10﹣60)。写出该反应的离子方程式_____________________,该反应的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施不能有效防止钢铁腐蚀的是( )
|
| A. | 在钢铁中加入铬 |
|
| B. | 把钢铁零件放在机油中保存 |
|
| C. | 在较小钢铁制品的表面包裹塑料 |
|
| D. | 在大型铁壳船表面喷涂油漆并铆上铜块 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com