
【题目】尿素[CO(NH2)2]是一种重要的工业原料,在160℃分解生成异氰酸和氨气,化学方程式为CO(NH2)2![]() 2HCNO+NH3↑。回答下列问题:
2HCNO+NH3↑。回答下列问题:
(1)上述反应所涉及的各元素中,原子半径最大的是________(填元素符号),其原子核外电子共占据________个原子轨道。
(2)上述元素中有三种元素处于同周期,则:
①最简单气态氢化物的稳定性由大到小的顺序是________(用化学式表示)。
②元素的第一电离能由大到小的顺序是________(用元素符号表示,下同)。
③元素的电负性由大到小的顺序是________________。
(3)氰酸有两种结构,一种分子内含有三键,称为氰酸,另一种分子内不含三键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。写出氰酸和异氰酸的结构式:________、________。
【答案】C 4 H2O>NH3>CH4 N>O>C O>N>C H-O-C≡N H-N=C=O
【解析】
(1)上述反应所涉及的元素为H、C、N、O,按不同周期、同周期元素原子半径的递变规律,确定原子半径最大的元素,利用电子排布式确定其原子核外电子共占据的原子轨道。
(2)①最简单气态氢化物的稳定性与非金属性成正比。
②元素的第一电离能总的趋势与非金属性成正比,但需注意N的反常情况。
③元素的电负性与非金属性成正比。
(3)书写氰酸和异氰酸的结构式时,可先确定已知共价键,再从稳定结构出发,确定原子的顺序及共价键的数目。
(1)上述反应所涉及的元素为H、C、N、O,H原子核外只有一个电子层,原子半径最小,C、N、O都是两个电子层,同周期且最外层电子数依次增多,依据同周期元素的原子半径递变规律,最外层电子数越多,原子半径越小,所以原子半径最大的是C,其原子核外电子排布式为1s22s22p2,共占据4个原子轨道。答案为:C;4;
(2)上述元素中,C、N、O三种元素处于同周期,则:
①最简单气态氢化物的稳定性与非金属性成正比,则由大到小的顺序是H2O>NH3>CH4。答案为:H2O>NH3>CH4;
②元素的非金属性O>N>C,但由于N的最外层电子半充满,电子的能量低,第一电离能出现反常,所以第一电离能由大到小的顺序是N>O>C。答案为:N>O>C;
③元素的电负性与非金属性成正比,则由大到小的顺序是O>N>C。答案为:O>N>C;
(3)氰酸分子内含有三键,异氰酸分子内不含三键,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构,则氰酸和异氰酸的结构式分别为:H-O-C≡N、H-N=C=O。答案为:H-O-C≡N;H-N=C=O。


科目:高中化学 来源: 题型:
【题目】羟基化合物在香料中占有重要的地位,下面所列的是一些天然的或合成的这类香料:
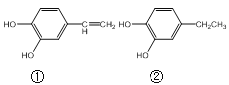

则下列说法正确的是( )
A.①与溴水反应后,溴水褪色说明分子中含有碳碳双键
B.③④相对质量相同,所以它们的质谱图相同
C.等物质的量的上述物质与足量的Na反应,产生氢气的量相同
D.1mol②与足量的溴水反应,消耗3molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4个碳原子间均以单键结合的方式有4种,请在下面的方框中补充另外3种结合方式:________________

(2)写出碳原子数为5的烷烃的同分异构体的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 等体积 | 相同时间内 |
|
B | 将湿润的淀粉- | 试纸只在 | 氧化性: |
C | 将光亮的镁条放入盛有 | 有大量气泡产生 | 生成的气体是 |
D | 向NaHCO3溶液中加入NaAlO2溶液 | 有白色沉淀生成 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯可用于制备二茂铁 [Fe(C5H5)2];二茂铁分子是一种金属有机配合物,结构如图所示,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。下列说法正确的是
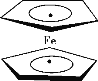
A.1 mol环戊二烯( ![]() )中含有5 mol σ键
)中含有5 mol σ键
B.环戊二烯分子中所有原子共平面
C.二茂铁分子中存在配位键
D.Fe2+的价电子排布式为3d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:
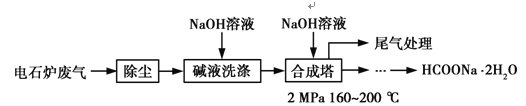
(1)上述工艺用碱液洗涤的目的是___________,可能发生的反应有______________(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________;最后尾气主要成分是__________________。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素﹣4是一种激光染料,应用于可调谐染料激光器。香豆素﹣4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
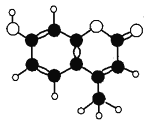
① 分子式为C10H9O3 ② 能与Br2水发生取代反应
③能与Br2水发生加成反应 ④能使酸性KMnO4溶液褪色
⑤ 1mol香豆素﹣4最多能与2molNaOH的溶液反应
A.①②③B.③④⑤C.②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

已知:![]() +CH3Cl
+CH3Cl![]() +HCl
+HCl
请回答下列问题:
(1)F的化学名称是__,②的反应类型是___。
(2)D中含有的官能团是__(写名称),D聚合生成高分子化合物的结构简式为___。
(3)反应③的化学方程式是___。
(4)反应⑥的化学方程式是___。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为___。
(6)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)___。
[示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br]
BrCH2CH2Br]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。 制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:
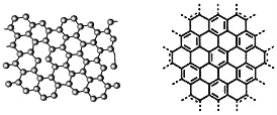
(1)下列有关石墨烯说法正确的是_____。
A 石墨烯的结构与金刚石相似 B 石墨烯分子中所有原子可以处于同一平面
C 12g 石墨烯含σ键数为 NA D 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含 碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:_____。
②乙醇沸点比氯乙烷高,主要原因是___________________。
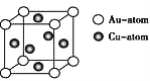
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:_______ 。
④含碳源中属于非极性分子的是______________(填序号)
a 甲烷 b 乙炔 c 苯 d 乙醇
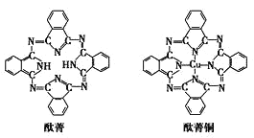
⑤酞菁与酞菁铜染料分子结构如下图,组成酞菁铜染料分子的元素,酞菁变成酞菁铜,分子中多 了什么作用力_____,酞菁铜分子中设计到的元素,电负性由小到大依次为_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com