
【题目】二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2 , 若充有10molCO发生反应:CO(g)+2H2(g)CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(CO)/mol | 10 | 7 | 5 | 5 |
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=mol/(Lmin);
(2)你认为p1p2(填“<”“>”或“=”)
(3)合成甲醇的反应为(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为 .
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有 .
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为: .
【答案】
(1)0.6
(2)<
(3)放热;Ka=Kb>Kc
(4)①③④⑤⑥
(5)2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol
【解析】解:(1)p2、T2时,0~lmin 内,CO的转化率是0.5,则参加反应的n(CO)=(10﹣7)mol=3mol,则v(CO)= ![]() =0.3mol/(L.min),根据反应速率之比等于计量数之比计算ν(H2)=2v(CO)=2×0.3mol/(L.min)=0.6mol/(L.min),
=0.3mol/(L.min),根据反应速率之比等于计量数之比计算ν(H2)=2v(CO)=2×0.3mol/(L.min)=0.6mol/(L.min),
所以答案是:0.6;(2)相同温度下,该反应的正反应是反应前后气体体积减小的可逆反应,增大压强平衡正向移动,CO的转化率增大,根据图知,相同温度下CO的转化率P1<P2 , 所以答案是:<; (3)升高温度,CO的转化率降低,说明平衡逆向移动,则正反应是放热反应,所以△H<0,
该反应的正反应是放热反应,升高温度平衡常数减小,AB温度相同且小于C,所以平衡常数Ka=Kb>Kc ,
所以答案是:放热;Ka=Kb>Kc;(4)能增加单位时间内CH3OH产量,说明增大正逆反应速率,可以通过增大反应物浓度、减小生成物浓度、升高温度、加入催化剂、增大压强等方法实现,
故选①③④⑤⑥;(5)碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g)△H=﹣Q1kJ/mol ①
碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,其热化学方程式为C(s)+ ![]() O2(g)=CO(g)△H=﹣Q2kJ/mol ②
O2(g)=CO(g)△H=﹣Q2kJ/mol ②
将方程式2(②﹣①)得2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol,
所以答案是:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
A.2mol
B.3mol
C.4mol
D.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构.请回答下列问题. 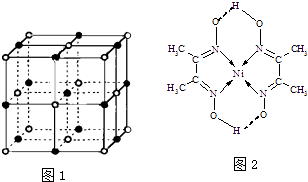
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
电离能/kJmol﹣1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显价,B元素的核外电子排布式为 .
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),已知3种离子晶体的晶格能数据如表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJmol﹣1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是 . 其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 .
(4)某配合物的分子结构如图2所示,其分子内不含有(填序号).
A.离子键
B.极性键
C.金属键
D.配位键
E.氢键
F.非极性键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( ) 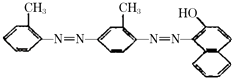
A.属于芳香烃
B.属于苯的同系物
C.属于氨基酸
D.能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快正反应速率,可以采取的措施有(填序号,下同). A.使用催化剂B.适当提高氧气的浓度C.适当提高反应的温度D.适当降低反应的温度
(2)铁镍蓄电池又称爱迪生电池,电池的电解液为碱性溶液,放电时的总反应为:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2①工作时电池负极是(填电极材料).
②负极电极反应式: .
③当外电路中通过0.2mol电子时,理论上消耗的铁的质量克
(3)已知该反应为放热反应,如图能正确表示该反应中能量变化的是 . 
(4)电池对环境的污染已经越来越被重视,下列有关电池的说法正确的是 A、电池一般比较小,即使埋到土壤中也不会造成太大危害
B、电池不仅污染土壤,也污染地下水
C、废旧电池可以直接通过燃烧的方式集中销毁
D、废旧电池集中处理,回收其中的汞、镉、镍等有价金属,有很好的发展前景.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( ) 
A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B.若x<3,C的平衡浓度关系为:c(M)<c(N)
C.若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
D.x不论为何值,平衡时M、N中的平均相对分子质量都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Cu投入到100mL18molL﹣1的浓硫酸中,加热使之充分反应,在标准状况下收集到4.48L气体(假设气体全部逸出).请计算:
(1)收集到气体的物质的量为mol.
(2)若往反应后的溶液中加入NaOH溶液,并使得溶液中的Cu2+完全沉淀,至少需要8molL﹣1NaOHmL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出能量121kJ,且氢气中1mol H-H键完全断裂时需要吸收能量436kJ,水蒸气中1mol H-O键形成时放出能量463kJ。则氧气中1mo O=O键断裂时吸收的能量为( )
A. 920 kJB. 557 kJC. 496 kJD. 188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验. (i)将钠、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多.
(ii)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(2)利用如图装置可验证同主族元素非金属性的变化规律 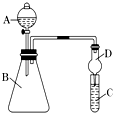
(i)干燥管D的作用是 .
(ii)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4 , (KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
(iii)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com