
【题目】以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
A.2mol
B.3mol
C.4mol
D.5mol
【答案】D
【解析】解:根据铁原子守恒知,2molFe(OH)3→2molFe(OH)2 , 所以生成2molFe(OH)3需要2molFe(OH)2; 活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O ![]() H2+Fe(OH)2↓,
H2+Fe(OH)2↓,
根据电解方程式得,生成2molFe(OH)2需要水的物质的量为4mol;
又氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
根据方程式得,生成2molFe(OH)3需要水的物质的量为1mol,
所以得到2molFe(OH)3沉淀消耗水的物质的量共为5mol.
故选D.
活泼金属铁作电解池阳极时,阳极上阳极材料铁失电子发生氧化反应生成亚铁离子进入溶液,亚铁离子和溶液中的氢氧根离子生成氢氧化亚铁沉淀,氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,注意消耗的水有两部分:一部分被电解生成氢气,一部分和氢氧化亚铁反应生成氢氧化铁.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)用铜、银与硝酸银设计一个原电池,此电池的负极是 , 负极的电极反应式是 .
(2)如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒. 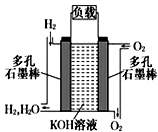
根据所学知识试回答下列问题:
①写出氢氧燃料电池工作时正极电极反应方程式: .
②如果该氢氧燃料电池每转移1mol电子,消耗标准状况下氧气的体积为 .
③阳离子向极移动(填写正或负),反应一段时间后整个溶液的碱性(填增强,减弱或者不变).
④若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
A.①③④
B.①②③④
C.①④
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水电解:2H2O ![]() 在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( ) 
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:H2﹣2e﹣=2H+
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物.
(1)请写出下列元素的元素符号:Z , W;请写出Y2O2的电子式: .
(2)X、Z、W三种元素的最高价氧化物对应的水化物中,酸性最强的是(填化学式):
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应,请写出实验室制备该气体的化学反应方程式;检验该气体是否收集满的操作方法
(4)Q是和Y同一主族的原子序数最大的元素,下列关于Q的说法正确的有 A.熔点较低
B.不与水反应
C.其最高价氧化物对应水化物为碱性
D.可以电解其熔融态的氯化物制取
E.碳酸盐受热易分解为氧化物和二氧化碳.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.请回答下列问题: 
(1)装置A中盛放亚硫酸钠的仪器名称是 , 其中发生反应的化学方程式为;
(2)实验过程中,装置B、C中发生的现象分别是、 , 这些现象分别说明SO2具有的性质是和;装置B中发生反应的离子方程式为;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象;
(4)尾气可采用溶液吸收.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蛋白质的叙述中,不正确的是( )
A.蛋白质水解的最终产物为葡萄糖
B.酒精消毒的原理是酒精能使蛋白质变性
C.重金属盐能使蛋白质变性凝结,所以误食重金属盐会中毒
D.浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2 , 若充有10molCO发生反应:CO(g)+2H2(g)CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(CO)/mol | 10 | 7 | 5 | 5 |
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=mol/(Lmin);
(2)你认为p1p2(填“<”“>”或“=”)
(3)合成甲醇的反应为(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为 .
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有 .
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com