
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:038
将27.2g表面有铁锈(主要成分为Fe2O3)的铁片投入适量的稀H2SO4中,固体完全溶解,收集到2.24L(标准状况)气体。向反应后的溶液中滴入NH4SCN溶液时,未见血红色物质。计算铁片上铁锈的质量分数。
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高一上学期期末质检化学试卷(解析版) 题型:选择题
为研究铁及其化合物的性质,某探究小组进行如下实验:将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间,取适量浸泡后的溶液滴入少量KSCN溶液,未见溶液呈血红色。请根据要求回答问题:
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应。
①铁锈与稀硫酸反应的化学方程式为__________________________。
②“还发生另一个反应”对应的离子方程式应为______________________________。
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中。
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
|
实验操作 |
实验现象 |
实验结论 |
|
取适量铁钉与稀硫酸浸泡后的溶液于试管中,____________________ __________________________。 |
__________________ __________________ _________________。 |
乙同学的观点____________ (填“正确”或“错误”)。 |
查看答案和解析>>
科目:高中化学 来源:2014届福建省福州八县市高三上学期期中联考化学试卷(解析版) 题型:填空题
利用废的生铁丝(表面有铁锈)、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下图:
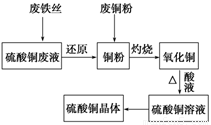
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是__________________,可能发生反应的离子方程式有Fe+2H+=Fe2++H2↑、_____________________、__________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO未被还原。还原剂是_______________。
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的_____;
②写出反应的化学方程式:_____________、________________________________。
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为________________________。
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将13.6g表面有铁锈(主要成份为Fe2O3)的铁片,投入适量稀HC1中,固体完全溶液,并收集到1.12L气体(标标况下)。向反应溶液中滴入KSCN溶液,无明显变化,求铁片上铁锈的质量是多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com