
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)步骤①获得Br2的离子反应方程式为:_________________________。
(2)步骤③所发生反应的化学方程式为:_________________________。在该反应中,氧化剂是______________(填化学式);若反应中生成2molHBr,则转移电子数约为_____________个。
(3)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是:_______________。
(4)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
【答案】Cl2 + 2Br- = Br2 + 2Cl- Br2 + SO2 + 2H2O = 2HBr + H2SO4 Br2 1.204×1024 Cl2 >Br2> SO2 C
【解析】
从流程图中分析可知,苦卤中含有溴,在酸性条件下通入氯气,可发生置换反应生成溴单质,吹入空气,将溴分离出来,然后溴与二氧化硫发生反应生成HBr和硫酸,再通入氯气,生成溴,然后分液、蒸馏最终得到液溴,
(1)步骤①是氯气氧化溴离子获得Br2的过程;
(2)步骤③是用二氧化硫将溴还原生成溴离子,再根据氧化还原反应的规律找出氧化剂,及电子转移数与生成的HBr之间的关系得出答案;
(3)所含元素化合价降低的反应物为氧化剂,在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,根据反应Cl2 + 2Br- = Br2 + 2Cl-及Br2 + SO2 + 2H2O = 2HBr + H2SO4得出答案;
(4)溴易从液态转化为气态,故步骤②通入热空气或水蒸气吹出Br2,利用了溴的挥发性。
从流程图中分析可知,苦卤中含有溴,在酸性条件下通入氯气,可发生置换反应生成溴单质,吹入空气,将溴分离出来,然后溴与二氧化硫发生反应生成HBr和硫酸,再通入氯气,生成溴,然后分液、蒸馏和得到液溴,
(1)步骤①是氯气氧化溴离子获得Br2的过程,则离子方程式为:Cl2 + 2Br- = Br2 + 2Cl-,
故答案为:Cl2 + 2Br- = Br2 + 2Cl-;
(2)步骤④是用二氧化硫将溴还原生成溴离子,所发生反应的化学方程式为Br2 + SO2 + 2H2O = 2HBr + H2SO4,Br2化合价降低转化成HBr,被还原,作氧化剂,又因为Br2![]() 2e-
2e-![]() 2HBr关系式可知,生成2 mol HBr则转移的电子的物质的量为2 mol,根据n =
2HBr关系式可知,生成2 mol HBr则转移的电子的物质的量为2 mol,根据n = ![]() 得出转移电子数N = 2
得出转移电子数N = 2![]() = 2
= 2![]() 6.02
6.02![]() 1023 = 1.204
1023 = 1.204![]() 1024个,
1024个,
故答案为:Br2 + SO2 + 2H2O = 2HBr + H2SO4;Br2;1.204×1024
(3)在氧化还原反应中,反应物元素化合价降低,被还原,作氧化剂,氧化剂的氧化性大于氧化产物的氧化性,根据反应Cl2 + 2Br- = Br2 + 2Cl-,可知氧化性:Cl2>Br2;再根据反应Br2 + SO2 + 2H2O = 2HBr + H2SO4可以看出,氧化性Br2> SO2,因此可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是:Cl2 >Br2> SO2,
故答案为:Cl2 >Br2> SO2;
(4)溴易从液态转化为气态,故步骤②通入热空气或水蒸气吹出Br2,利用了溴的挥发性,故C项正确,
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示是两种气态烃组成的混合气体完全燃烧所得的CO2和H2O的物质的量(单位:mol)的变化关系。下列判断不正确的是:
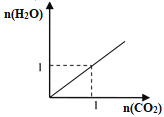
A. 一定含有甲烷
B. 可能含有乙烷
C. 可能含有乙炔
D. 若120℃不变,反应前后气体体积不一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 3d3表示3d能级上有3个轨道
B. ns能级的原子轨道图都可以用如图表示
C. 1s电子云呈球形,表示电子绕原子核做圆周运动
D. 电子云图的黑点密度越大,说明核外空间电子数越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.CaO+H2O=Ca(OH)2
C.2CO+O2![]() 2CO2D.CaCO3
2CO2D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为_________,电子排布式是________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_______。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式________________。
(3)与B一个周期的元素Be和C,它们的电离能由小到达的顺序 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸反应可生成CH4;
②AIN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:____________。
(2)实验装置(如图所示,量气管为碱式滴定管改装)

连好装置后,首先应进行的操作是________。
(3)实验过程:称得装置D的初始质量为yg;称取xgAlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为amL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对三个活塞的操作是________。
②若无恒压管,对所测气体体积的影响是________(填“偏大”“偏小”或“无影响”)
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行的操作为____;若量气管中的液面高于右侧球形容器中的液面,所测气体的体积______(填“偏大”“偏小”或“无影响”)。
④记录滴定管的读数为bmL(已知:该实验条件下的气体摩尔体积为VmL·mol-1),则Al4C3的质量分数为______(用含a、b、x、y、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞__,打开活塞___,通过分液漏斗加入过量___,与装置B瓶内物质充分反应;反应完成后,____(填入该步应进行的操作),最后称得装置D的质量为zg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为2:1,以下说法正确的是 ( )
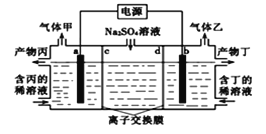
A. b电极反应式:2H2O+4e-=O2↑+4H+
B. 离子交换膜d为阴离子交换膜
C. 丙为硫酸溶液,丁为氢氧化钠溶液
D. a电极连接电源的正极作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。

(1)用离子方程式解释AgNO3溶液pH<7的原因是____________________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为Ag+和SO42—(Ag2SO4可溶于硝酸);
ii. Ag2O能溶解在浓氨水中形成银氨溶液[Ag(NH2)2OH],而Ag2S和Ag均不能。
①设计并实施如下实验,证实沉淀中含有Ag2S,试剂1和试剂2分别是_________、________。

现象1中出现的现象是_______________________________。
②设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作补充完整。
实验操作 | 实验现象 | |
步骤i | 其少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀, ____________ | 没有沉淀出现 |
写出步骤i中反应的化学方程式:_________________________。
③经检验,沉淀中不含有Ag。
(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如图所示),测得电压为a (a>0)。对AgNO3溶液中氧化S2—的物质进行推测:
假设1:0. 1 mol/L AgNO3溶液(pH=4)中的Ag+氧化了S2—;
假设2:0. 1 mol/L AgNO3溶液(pH=4)中的NO3—氧化了S2—
利用下图装置继续研究(已知:电压大小反映了物质氧化性与还原性强弱的差异;物质氧化性与还原性强弱的差异越大,电压越大)。

①将pH=4的0. 1 mol/L AgNO3溶液替换为_____溶液,记录电压为b(b>0)
②上述实验证实了氧化S2—的物质中一定包含了Ag+,其证据是_________实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)

请回答下列问题:
(1)仪器1的名称是__________;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是__________(填序号);目的是______________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门__________(填“A”或“B”,下同),打开阀门___________________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是__________________________。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O 9.024g,则该实验所得产品的产率为__________(不考虑溶解的M)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的________,再加入碱液,调节pH至少为________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。(已知Cr(OH)3的溶度积为6.3×10-31,![]() =4,lg2≈0.3)
=4,lg2≈0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com