
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、生铁比纯铁容易生锈 |
| C、铁质器件附有铜质配件,在接触处易生铁锈 |
| D、银质物品久置表面变暗 |


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
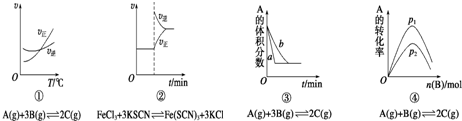
| A、①是其他条件一定时,反应速率随温度变化的图象,正反应△H>0 |
| B、②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 |
| C、③是在有无催化剂存在下建立的平衡过程图象,b是使用催化剂时的曲线 |
| D、④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2CH3CH2OH+O2
| |||
B、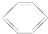 +HNO3 +HNO3
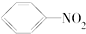 +H2O +H2O | |||
C、CH3CH2OH+CH3COOH
| |||
D、CH4+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、活化分子碰撞即发生化学反应 |
| B、升高温度会加快反应速率,其主要原因是增加了活化分子碰撞的次数 |
| C、有气体参加的化学反应,若增大压强,可增大活化分子百分数,从而使反应速率增大 |
| D、活化分子间的碰撞不一定是有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ |
| B、电极Ⅰ发生还原反应 |
| C、电极Ⅳ逐渐溶解 |
| D、电极Ⅲ的电极反应:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(2)(4)(7)(12) |
| B、(3)(6)(8)(11) |
| C、(1)(5)(9)(14) |
| D、(5)(7)(10)(12) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/molNa2O2(s)+CO2(g)=Na2CO3(s)+
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/molNa2O2(s)+CO2(g)=Na2CO3(s)+| 1 |
| 2 |
| A、CO的燃烧热为-283 kJ |
| B、如图可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol |
| D、CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移总数为6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com