
(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+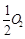 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。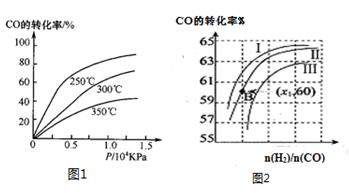
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
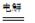 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。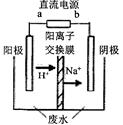
(16分)
(1) SO2(g)+2CO(g)=S(s)+2CO2(g) ΔH=-237.4kJ·mol-1(3分)
(2)①<(1分) K1>K2>K3(2分) 3 (2分)
②A C (2分) ③4.5 L2·mol-2 (不带单位不扣分)(2分)
(3)①CH3CHO-2e-+H2O═CH3COOH+2H+ (2分) ②0.19(2分)
解析试题分析:(1)根据盖斯定律得,目标方程式=②×2-①×2-③,ΔH=(-393.5kJ·mol-1)×2-(-126.4kJ/mol)×2-(-296.8kJ·mol-1)=-237.4kJ·mol-1,所以所求热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) ΔH=-237.4kJ·mol-1;
(2)①由图1可知,温度升高CO的转化率降低,说明升高温度,平衡逆向移动,正向是放热反应,ΔH<0;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大,所以K1、K2、K3的大小关系为K1>K2>K3测得B(X1,60)点氢气的转化率为40%,CO的转化率是60%,设B点时CO、H2的物质的量分别是m、n,可得60%m=40%n/2,所以n/m=3,即x1=3;
②A、增大反应物浓度,正反应速率先增大后减小,说明平衡正向移动,正确;B、增大生成物浓度,逆反应速率先增大后减小,说明平衡逆向移动,错误;C、降低温度,K值增大,说明生成物浓度增大,反应物浓度减小,平衡正向移动,正确;D、减小压强,平衡逆向移动,反应物的体积百分含量增大,错误;E、恒容条件时混合气体的密度增大,说明容器中气体质量增加,可能是反应物也可能是生成物,平衡移动方向不确定,错误,答案选AC;
③设平衡时CO的浓度是x,则氢气的浓度是2x-1,生成甲醇的浓度是1-x,根据题意得:x/(2x-1)=2:1,x=2/3mol/L,所以K=(1-x)/x·(2x-1)2=4.5 L2·mol-2
(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气,则阴极发生还原反应,乙醛被还原为乙醇,同时氢离子被还原为氢气,所以阳极电极反应式除生成氧气外,还有CH3CHO-2e-+H2O═CH3COOH+2H+
②阴极反应是CH3CHO+2e-+2H+=CH3CH2OH,所以注入1m3乙醛的含量为300mg/L的废水,阴极区乙醛的去除率可达60%,生成乙醇的质量是1000L×300mg/L×60%×10-3g/mg÷44g/mol×46g/mol=188.2g=0.19kg。
考点:考查盖斯定律的应用,化学平衡图像的分析及平衡理论应用,电化学原理的应用


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
、随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。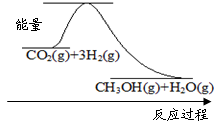
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示(图中字母后的数字表示对应的坐标)。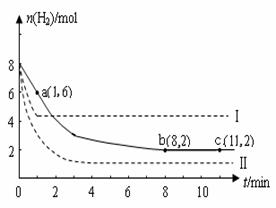
①在反应进行的0~1min内,该反应的平均速率v(H2)= 。
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),反应将向着能够减弱这种改变的方向进行(如增大H2的浓度,反应向右进行以减弱外界条件增大H2的浓度的影响)直至达到新的平衡。若上述反应体系不改变反应物的物质的量,仅分别改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是 ,曲线Ⅱ改变的实验条件是 。
(3)下列各项中,不能够说明CO2(g)+3H2(g)  CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
| A.恒温、恒容条件下,容器内的压强不发生变化 |
| B.一定条件下,CH3OH消耗的速率和CH3OH生成的速率相等 |
| C.一定条件下,H2O(g)的浓度保持不变 |
| D.一定条件下,单位时间内消耗1 mol CO2,同时生成1 mol CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1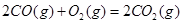 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1 与
与 反应生成
反应生成 热化学方程式 。
热化学方程式 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO  2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。| 实验编号 | T/℃ | NO初始浓度 mol·L-1 | CO初始浓度 mol·L-1 | 催化剂的比表面积 ㎡·g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | | | 5.8×10-3 | 124 |
| Ⅲ | 350 | 1.2×10-3 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: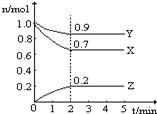
(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应 ②逆反应 ③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合理利用资源,降低碳的排放,实施低碳经济是今后经济生活主流方向。
⑴下列措施不利于有效减少二氧化碳排放的是 。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
⑵科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4比例混合通入反应器,适当条件下反应可获得一种能源。完成以下化学方程式:CO2+4H2 +2H2O。
+2H2O。
⑶CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO2和6 mol H2,发生:CO2(g)+3H2(g ) CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的质量保持不变
D.CO2生成速率与CH3OH生成速率相等
现测得CO2和CH3OH(g)的浓度随时间变化如左下图所示。从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。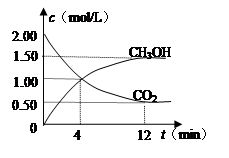
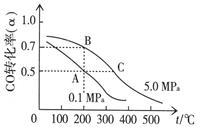
⑷CO在催化作用下也能生成甲醇:CO(g)+2H2(g)  CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
①若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则A、B两点时容器中,n(A)总︰n(B)总= 。
⑸以KOH为电解质的甲醇燃料电池总反应为:2CH3OH+3O2+4KOH= 2K2CO3+6H2O,通入甲醇的电极为燃料电池的负极,正极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知: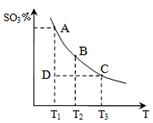
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO  2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。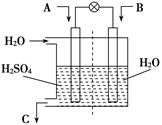
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为 L/min(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br - 氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)="2CuBr(s)+" Br2(g) △H=+105.4kJ/mol-1
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
反应Ⅰ Ni(S)+4CO(g)
 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0
反应Ⅱ Ni(CO)4(g)  Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2
(1)在温度不变的情况下,要提高反应Ⅰ中Ni(CO)4的产率,可采取的措施有 、 。
(2)已知350K下的2L密闭容器中装有100g粗镍(纯度98.5%,所含杂质不与CO反应),通入6 molCO气体发生反应Ⅰ制备Ni(CO)4,容器内剩余固体质量和反应时间的关系如图所示,10min后剩余固体质量不再变化。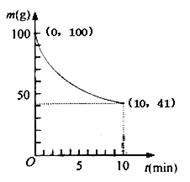
①反应Ⅰ在0~10min的平均反应速率v(Ni(CO)4)= 。
②若10min达到平衡时在右端得到29.5g纯镍,则反应Ⅰ的平衡常数K1为多少?(写出计算过程)
(3)反应Ⅱ中 △H2 0(填“>”、“<”、“=”);若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。(双选)
a.平衡常数K增大 b.CO的浓度减小 c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com