


| 实验内容 | 实验现象 | |
| A | 收集一集气瓶气体,观察颜色,然后向瓶内倒入约占瓶容积1/5的蒸馏水,充分振荡. | 蒸馏水呈浅黄绿色,瓶内气体仍呈黄绿色. |
| B | 取出瓶内部分溶液,滴入紫色石蕊试液中直至过量. | 紫色石蕊试液先变红色,后红色褪色. |
| C | 取出瓶内剩下的部分溶液,滴入硝酸银溶液中. | 产生大量白色沉淀 |
| D | 最后向瓶内倒入少量浓氢氧化钠溶液,振荡. | 瓶内黄绿色气体立即消失. |
| ||

| ||
 ;
;

科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(21分)
(1)在上面元素周期表中全部是金属元素的区域为 。
(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实
验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
、 。
(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序___________________________(填元素符号)。
②以上元素形成的金属单质中,熔点最低的是____________________(填元素符号)。
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
____________________________________________________________(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
___________________________________________________________。
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
_____________________________________________________________________。
⑥c元素的单质用途_______________________________________________(填一条)。
查看答案和解析>>
科目:高中化学 来源:09—10年成都石室中学高一下期期末考试化学卷 题型:填空题
(21分)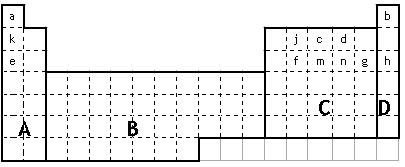
(1)在上面元素周期表中全部是金属元素的区域为 。


(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实
验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
、 。


(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序___________________________(填元素符号)。
②以上元素形成的金属单质中,熔点最低的是____________________(填元素符号)。
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
____________________________________________________________(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
___________________________________________________________。
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
_____________________________________________________________________。
⑥c元素的单质用途_______________________________________________(填一条)。
查看答案和解析>>
科目:高中化学 来源:09-10年成都石室中学高一下期期末考试化学卷 题型:填空题
(21分)
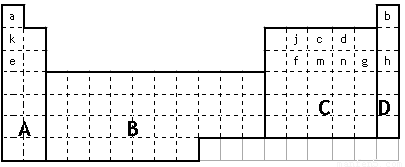
(1)在上面元素周期表中全部是金属元素的区域为
。

(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实
验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
、
。
(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序___________________________(填元素符号)。
②以上元素形成的金属单质中,熔点最低的是____________________(填元素符号)。
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
____________________________________________________________(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
___________________________________________________________。
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
_____________________________________________________________________。
⑥c元素的单质用途_______________________________________________(填一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)在上面元素周期表中全部是金属元素的区域为 。
(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实
验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
、 。
(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序___________________________(填元素符号)。
②以上元素形成的金属单质中,熔点最低的是____________________(填元素符号)。
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
____________________________________________________________(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
___________________________________________________________。
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
_____________________________________________________________________。
⑥c元素的单质用途_______________________________________________(填一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com