
����Ŀ��ij��ѧ��ȤС�鷢��ʵ�����ж������ʻ���ɫ�Ľ�����Ʒ�� ���˽�����Դ�������������(���±�)������ȷ��Ϊͭ��Ʒ��
��ͭ | ��ͭ | ͭ�� | |
��Ҫ�ɷ� | ��ͭ | ͭ���Ͻ� | Cu2(OH)2CO3 |
��������; | �Ϻ�ɫ�� �����������������ã���Ҫ�������ߵ��¡� | ��ʻ���ɫ�� �۵�͡�Ӳ�ȴ� ������ǿ��������ɸ������ߡ� | ������ˮ�Ļ���ɫ��ĩ�������ᣬ �����ֽ⣻�������ϡ�ɱ����� |
���ͭ��Ʒ����Ļ���ɫ���ʾ�����ʲô��ͬѧ������˶��ֲ��벢չ��ʵ��̽����
��������衿
(1)С��ͬѧ��Ϊ�����Ǵ�ͭ��Ʒ����Ϳ���˻���ɫ�����
С��ͬѧ��Ϊ��������ͭ(ͭ���Ͻ�)����Ϊ��������ͭ�ǻ���ɫ�ģ�
С��ͬѧ��Ϊ�Ǵ�ͭ��Ʒ��ֻ�DZ��泤����ͭ��[ Cu2(OH)2CO3 ]��
�����������⣬���������IJ�����____________________(ֻдһ��)��
��ʵ����֤����λͬѧΪ����֤���������IJ��룬����������̽����
(2)С����²��ֻ���ɫ���ʷ���ȼ�ճ��н������գ����ָ����ʲ���ȼ�գ�֤������ɫ���ʲ������ᡣ ���ж�������________________________��
(3)С�ܹ��������Ļ���ɫ����Ͷ��������Һ�У��۲쵽�����������ʵ����������岻��ȼ�ա�������ξ����ͭ��ƷҲͶ�������У���������������ɴ�֤����ͭ��Ʒ������ͭ��������__________________��
(4)��������ʵ�飬С����Ϊ����ɫ���ʿ�����ͭ��[ Cu2(OH)2CO3 ]�����ǰ�ͼ5��ʾװ�ý���ʵ�顣
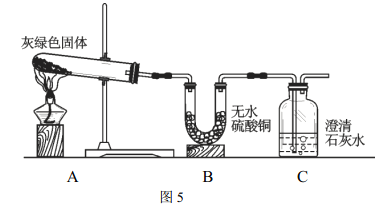
ʵ��֤��С�ƵIJ²�����ȷ�ģ���Ϊ��A�й۲쵽����ɫ���ʱ�ڣ�B�й۲쵽��___________������ C�й۲쵽��_____________������B����������Ӧ�Ļ�ѧ����ʽΪ��__________________��
�����ʵ��װ���е�B��C���е����������ó�����ɫ������ͭ�̵Ľ��ۣ�ԭ����______________��
��ʵ����չ��
(5)С��ͬѧ���������ҵ������ð�ˮ����ȥ��ͭ�̵ķ�������ԭ���ǰ�ˮ���ʽ̼��ͭ��Ӧ����ͭ��������[Cu(NH3)42+]�������ӷ���ʽ�ɱ�ʾΪ��___________________________��
���𰸡�(1)��ͭ���泤����ͭ��(ͭ��Ʒ���渽����������ɫ���ʵĺ�����Ҳ����)
(2)�������л����ȼ(�����ǿ�ȼ��)
(3)��ͭ�к��н��������������ᷴӦ��������
(4)��ɫ�������ɫ����ʯ��ˮ�����
CuSO4+5H2O=CuSO4��5H2O(2��)��ȷ���ֽ�������Ƿ���ˮ
(5)Cu2(OH)2CO3+8NH3��H2O=2Cu(NH3)42+2OH-+CO32-+8H2O(2��)
��������
�����������������衿(1)С��ͬѧ��Ϊ�����Ǵ�ͭ��Ʒ����Ϳ���˻���ɫ�����
С��ͬѧ��Ϊ��������ͭ(ͭ���Ͻ�)����Ϊ��������ͭ�ǻ���ɫ�ģ�
С��ͬѧ��Ϊ�Ǵ�ͭ��Ʒ��ֻ�DZ��泤����ͭ��[Cu2(OH)2CO3]��
������������𰸿�֪�������������⣬���ܵIJ�������ͭ���泤����ͭ�̣�
��������衿(2)�����ǿ�ȼ�С����²��ֻ���ɫ���ʷ���ȼ�ճ��н������գ����ָ����ʲ���ȼ�գ�֤������ɫ���ʲ������
(3)С�ܹ��������Ļ���ɫ����Ͷ��������Һ�У��۲쵽�����������ʵ����������岻��ȼ�գ�������ξ����ͭ��ƷҲͶ�������У��������������֤����ͭ��Ʒ������ͭ����Ϊ��ͭ��ͭ�����ĺϽ���ͭ�к��н��������������ᷴӦ����������
(4)С��ͬѧ��Ϊ�Ǵ�ͭ��Ʒ��ֻ�DZ��泤����ͭ��[Cu2(OH)2CO3]��A�б��˵���ֽ���������ͭ��B�б�������Ϊ��ˮ����ͭ��ˮ��Ӧ��������ͭ�ᾧˮ���֤���ֽ�������ˮ�������ķ�ӦΪ��CuSO4+5H2O=CuSO45H2O��װ��C�г���ʯ��ˮ�����֤�������˶�����̼���壬�����ʵ��װ���е�B��C���е����������ó�����ɫ������ͭ�̵Ľ��ۣ���Ϊ���� ���ɵ�ˮ��֤����
��ʵ����չ��(5)��ˮ�ͼ�ʽ����ͭ������Ӧ���ɿ����Ե�ͭ���������ӷ���ʽΪCu2(OH)2CO3+8NH3H2O=2[Cu(NH3)4]2++CO32-+2OH-+8H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨�ϵļ�¼�����£���Ƭ�ϵ������������ǣ� ��
ʵ���ļ�¼��

��Zn������Cu����
��Cu���������ݲ�����������ԭ��Ӧ
��SO42����Zn���ƶ�
������0.5mol�����������ߣ������5.6L����
�������������ǣ�Cu��Zn
��������Ӧʽ��Cu��2e���TCu2+������������Ӧ��
A���ڢܢ� B���ڢۢ� C���٢ܢ� D���ۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ijͬѧΪ̽��Ԫ�����ڱ���ͬ����Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮

��1�����ơ�þ������1 mol�ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ������________�����ᷴӦ����ң� ________�����ᷴӦ������������࣮
��2����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ__________��
��.������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯����
��3�������D�������� ��
��4����Ҫ֤���ǽ����ԣ�Cl>I����A�м�Ũ���ᣬB�м�KMnO4��(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ��۵⻯�ػ����Һ���۲쵽C����Һ ������ ����֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã����� ��Һ����β����
��5����Ҫ֤���ǽ����ԣ�C>Si������A�м����ᡢB�м�CaCO3��C�м�Na2SiO3��Һ���۲쵽C����Һ ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ���C�и���ʵ�飬Ӧ����װ�ü�����װ�� ��Һ��ϴ��ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���֬�����ŵĹ���ζ��������Ϊ������
A. ������Ӧ B. �ӳɷ�Ӧ C. ȡ����Ӧ D. ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л��ﺬ��C��H��O����Ԫ�أ��������ܶ�����ͬ������CH4�ܶȵ�3.625������1.16g���л�����O2�г��ȼ�գ���������ͨ��������ʯ�ң���ʯ������3.72g����֪���ɵ�CO2��H2O�����ʵ���֮��Ϊ1��1�����л������ʹ��ˮ��ɫ���ܺͽ����Ʒ�����Ӧ����H2����
(1)���л����Ħ������
(2)���л���ķ���ʽ
(3)���÷�������һ���ǻ���������״�ṹ�����л���Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��д���H+��Ca2+��Cl������Һ�У����ܴ�������������� �� ��
A.OH��
B.NO3��
C.CO32��
D.Ag +
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ĸ�Ч���öԱ����������ٽ����ó���������չ������Ҫ���á���β����Ҫ��Ca5(PO4)3F��CaCO3��MgCO3 ��ij�о�С���������β���ۺ����õ��о��������Ʊ�������Ҫ��ҵ��;��CaCO3��Mg(OH)2��P4��H2������������£�

��֪����Ca5(PO4)3F��950�治�ֽ⣻
��4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
��ش��������⣺
��1��950��������β�������������Ҫ�ɷ���___________��
��2��ʵ���ҹ�������IJ���������_____________��
��3��NH4NO3��Һ�ܴ�����н�ȡ��Ca2+��ԭ����__________��
��4���ڽ�ȡҺ����ͨ��NH3��������Ӧ�Ļ�ѧ����ʽ��____________��
��5����ҵ�ϳ�������[Ca5(PO4)3F]�����ᷴӦ�Ʊ����ᡣ��֪25�棬101kPaʱ��
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ��H=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ��H=-937kJ/mol
��Ca5(PO4)3F�����ᷴӦ����������Ȼ�ѧ����ʽ��_________________��
��6����һ��������CO(g)+H2O(g) ![]() CO2(g)+H2(g)����CO��H2O(g)����ʼ���ʵ���֮��Ϊ1:5����ƽ��ʱ��COת����
CO2(g)+H2(g)����CO��H2O(g)����ʼ���ʵ���֮��Ϊ1:5����ƽ��ʱ��COת����![]() ����a kg��Ca5(PO4)3F����Է�������Ϊ504������������Ϊ10%����β����������������b%��Ca5(PO4)3Fת��ΪP4����������CO��H2O(g)����ʼ���ʵ���֮��1:3��ϣ�����ͬ�����´�ƽ��ʱ�ܲ���H2________kg��
����a kg��Ca5(PO4)3F����Է�������Ϊ504������������Ϊ10%����β����������������b%��Ca5(PO4)3Fת��ΪP4����������CO��H2O(g)����ʼ���ʵ���֮��1:3��ϣ�����ͬ�����´�ƽ��ʱ�ܲ���H2________kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ���ǣ� ��
A.NH3��������ˮ�������ڹ�ҵ�����
B.HNO3�������ԣ��������Ʊ�������ԭ��
C.NH4 NO3������ˮ��������������²���
D.N2������ˮ�������ںϳɰ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������彡��������˵������ȷ����(����)
A. ��Ȫˮ���ж�����Ԫ�������������������彡��
B. Ӫ��ǿ�����Ե�Խ��Խ��
C. ����ѡ����ʳ����ȷʹ��ҩ�������彡���ı�֤
D. �ֱ���ʳƷ���ǷǴ���ҩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com