
| A. | 铝是地壳中含量最多的金属元素,在生活中有广泛的应用,但铝制品不宜长时间盛放腌制食品 | |
| B. | 世博停车场安装催化光解设施,可将汽车尾气中的CO和NOX反应生成无毒物质 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一 |
分析 A、铝制品盛放腌制食品会被腐蚀;
B、汽车尾气中的CO和NOX在催化剂的作用下能反应生成氮气和二氧化碳;
C、绿色化学的核心是原子利用率达100%,反应对环境无污染;
D、高容量的储氢材料可增大氢氧燃料电池的电量.
解答 解:A、铝制品盛放腌制食品时,氧化铝薄膜中的氧离子会被氯离子替代生成氯化铝,从而氧化膜被破坏,金属铝会被腐蚀,故A正确;
B、CO和NOx在催化作用下可生成氮气和二氧化碳,可达到环境保护的目的,故B正确;
C、绿色化学的核心是原子利用率达100%,反应对环境无污染,从源头杜绝化学污染,以预防污染为主,故C错误;
D、高容量的储氢材料可增大氢氧燃料电池的电量,是推广应用氢氧燃料电池的关键问题之一,故D正确.
故选C.
点评 本题考查环境污染知识,题目难度不大,本题主要为高分子化合物、绿色化学、燃料电池等知识,学习中注意全面了解化学基础知识.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA | |
| B. | 15.6g Na2S和Na2O2固体混合物中,含有的阴离子数为0.2NA | |
| C. | 1L 1mol/L的盐酸中含有HCl分子数为NA | |
| D. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A3B | B. | A3B2 | C. | AB3 | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的水溶液不一定显碱性 | |
| B. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比分别均为1:2 | |
| C. | 原子半径由大到小排列的顺序是:Z>R>W>Y>X | |
| D. | 由于X、Y组成化合物分之间可以形成氢键,使X、Y组成化合物的稳定性高于X、R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
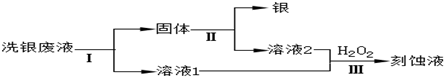
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2B的酸性比HA的强 | |
| B. | 当NaA、NaHB、Na2B的溶液浓度都是0.1mol•L-1时,Na2B溶液pH最大 | |
| C. | HA和H2B不一定是弱酸 | |
| D. | 溶液中B2-、HB-、A-均能和强酸反应,也能和强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英玻璃是以纯碱、石灰石和二氧化硅为原料制成的 | |
| B. | 氮的固定是指将空气中游离的氮转变为氮的化合物的方法 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 纳米材料是指一种称为“纳米”的新物质制成的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com