
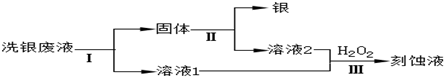
���� ��1��������ˮ���������������������ӣ���Һ�����ԣ�
��2�����ݷ�ӦFe3++Ag?Fe2++Ag+�������ж������Ӳ��䣬��Ԫ���������䣻
��3�����������������Һ�о��������ԣ��������������������ӣ�
��4����ϴ����Һ��Fe3+��Fe2+��Ag+��NO3-���л������Ϳ�ʴҺ��Ҫ�ȼ����������ԭFe3+��Ag+��
���Լ������ܽ����������
��5����������Һ�м���������������Ȼ�����
�������AgCl�м����ǰ���NH2OH������ַ�Ӧ��ɵ������ǰ�������ΪN2����ӦΪ��2AgCl+2NH2OH=N2��+2Ag+2H2O+2HCl�����ݷ�Ӧ���㣮
��� �⣺��1��FeCl3��Һ����������Ϊ������ˮ���������������������ӣ���Ӧ�����ӷ���ʽΪ��Fe3++3H2O?Fe��OH��3+3H+��
�ʴ�Ϊ��Fe3++3H2O?Fe��OH��3+3H+��
��2��FeCl3��Һϴ����������ӦΪ��Fe3++Ag?Fe2++Ag+��
a��c��Fe3+����С����a���ϣ�������
b�� c��Cl-���ı䣬��b�����ϣ�������
c����Ԫ�ش�����ʽ��ͬ�����������С����c�����ϣ�
�ʴ�Ϊ��a��
��3��ͨ������Fe��NO3��3��Һϴ����NO3-�Ļ�ԭ�������ж�NO3-�Ƿ��ܽ�����������Ҫ������Һ�У���������Ҳ�ᷴӦ����÷��������У�
�ʴ�Ϊ�������У�����������NO3-Ҳ������Fe2+����������ԭ��Ӧ��
��4����ϴ����Һ��Fe3+��Fe2+��Ag+��NO3-���л������Ϳ�ʴҺ��Ҫ�ȼ����������ԭFe3+��Ag+����Ӧ�����ӷ���ʽΪ��2Fe3++Fe=3Fe2+��Fe+2Ag+=Fe2++2Ag��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Fe+2Ag+=Fe2++2Ag��
�ڹ��̢��м�����Լ����ܽ����������������ϡ�����ϡ���
�ʴ�Ϊ��ϡ�����ϡ���
��5����������Һ�м���������������Ȼ�����ͬʱ�����Ȼ�狀�ˮ����Ӧ�Ļ�ѧ����ʽΪ��Ag��NH3��2OH+3HCl=AgCl��+2NH4Cl+H2O��
�ʴ�Ϊ��Ag��NH3��2OH+3HCl=AgCl��+2NH4Cl+H2O��
�������AgCl�м����ǰ���NH2OH������ַ�Ӧ��ɵ������ǰ�������ΪN2����ӦΪ��2AgCl+2NH2OH=N2��+2Ag+2H2O+2HCl����Ӧ������3.3g�ǰ����ʵ���=$\frac{3.3g}{33g/mol}$=0.1mol�����������ʵ���Ϊ0.1mol������Ϊ10.8g��
�ʴ�Ϊ��10.8��
���� ���⿼�����ʵ�����ʵ�飬Ϊ��Ƶ���㣬������ѧ���ķ�����ʵ�������Ŀ��飬��Ŀע�ػ������õ���ȡ������������жϣ��Լ�ѡ���Ŀ�ģ����ӷ���ʽ��ѧ����ʽ��д�ķ������������������ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������0.1 mol Znʱ���õ��Ļ�ԭ����Ϊ0.1 mol | |
| B�� | ����Һ�в��ٲ�������ʱ����Һ�д������ڵ���������Zn2+ | |
| C�� | ���е����ֵ�������ʱ�����ĵ�п���������ٴ���13 g | |
| D�� | ��Ӧ����ʱ���ɵõ�0.25 mol ZnSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����������������Ʊ���������ͭ��Ӧ�����ĵ�������������ͭ�����ֱ�Ϊ��������
�����������������Ʊ���������ͭ��Ӧ�����ĵ�������������ͭ�����ֱ�Ϊ��������| A�� | 1 mol��2 mol | B�� | 1 mol��4 mol | C�� | 3 mol��2 mol | D�� | 3 mol��4 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ǵؿ��к������Ľ���Ԫ�أ����������й㷺��Ӧ�ã�������Ʒ���˳�ʱ��ʢ������ʳƷ | |
| B�� | ����ͣ������װ�������ʩ���ɽ�����β���е�CO��NOX��Ӧ���������� | |
| C�� | ��ɫ��ѧ�ĺ�����Ӧ�û�ѧԭ���Ի�����Ⱦ�������� | |
| D�� | �������Ĵ�������о����ƹ�Ӧ������ȼ�ϵ�صĹؼ�����֮һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ư��Һ��ͨ������������̼��ClO-+H2O+CO2�T${CO}_{3}^{2-}$+2HClO | |
| B�� | ����ʱƫ��������ҺpH��7��${AlO}_{2}^{-}$+2H2O�TAl��OH��3��+OH- | |
| C�� | �����ʵ���Ũ�ȵ�FeI2��Һ����ˮ�������ϣ�2Fe2++2I-+2Br2�T2Fe3++I2+4Br- | |
| D�� | ������������Һ�еμ�Ba��OH��2��Һǡ����������ȫ��H++${SO}_{4}^{2-}$+Ba2++OH-�TBaSO4��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{125a}{72V}$ mol•L-1 | B�� | $\frac{125a}{36V}$ mol•L-1 | C�� | $\frac{250a}{36V}$ mol•L-1 | D�� | $\frac{250a}{48V}$ mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com