(1)今有反应2H2+O2=2H2O(KOH为电解质),构成燃料电池,则负极通的是:______,正极通的是:______正、负极的电极反应式分别为:______,______
(2)若将KOH改为H2SO4,则正、负极的电极反应式分别为:______,______(1)和(2)的电解液不同,反应进行后,其溶液的pH变化依次为:______,______.
【答案】分析:(1)依据原电池的原理分析判断,失电子的做负极发生氧化反应,正极上得到电子发生还原反应;反应中氢气失电子生成氢离子,注意电解质溶液是碱溶液,所以电解反应应写成生成水的反应;反应中氧气在正极得到电子生成氢氧根离子发生还原反应;原电池反应后生成水,溶液中氢氧化钾浓度减小;
(2)依据原电池的原理分析判断,失电子的做负极发生氧化反应,正极上得到电子发生还原反应;反应中氧气得到电子生成氢氧根离子,注意电解质溶液是酸溶液,所以电解反应应写成生成水的反应;氢气在负极失电子生成氢离子;原电池反应后生成水,溶液中硫酸浓度减小;
解答:解:(1)反应2H2+O2=2H2O(KOH为电解质),构成燃料电池,则负极失电子发生氧化反应,通的是H2,电极反应为:2H2+4OH--4e-=4H2O;正极上得到电子发生还原反应,通的是O2;电极反应为:O2+2H2O+4e-=4OH-;
故答案为:H2,O2,O2+2H2O+4e-=4OH-;2H2+4OH--4e-=4H2O;
(2)若将KOH改为H2SO4,则正、负极的电极反应式分别为:O2+4H++4e-=2H2O 2H2-4e-=4H+;(1)和(2)的电解液不同,反应进行后,其溶液的pH变化依次为(1)电池反应时生成水,溶液中氢氧根离子浓度减小,PH减小;(2)电池反应时生成水,溶液中氢离子离子浓度减小,PH增大;
故答案为:O2+4H++4e-=2H2O;2H2-4e-=4H+;变小,变大;
点评:本题考查了原电池原理的应用,主要考查氢氧燃料电池的工作原理和电极判断,电极反应,注意电解质环境不同,电极反应式不同.



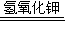 2H2O,构成燃料电池,则负极通的应是______,电极反应式为:______;正极通的应是______,电极反应式为:______.
2H2O,构成燃料电池,则负极通的应是______,电极反应式为:______;正极通的应是______,电极反应式为:______.