
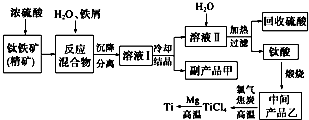
 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:
| ||
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、混合气体中一定有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定有乙烷 |
| D、混合气体中一定有乙炔(CH≡CH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
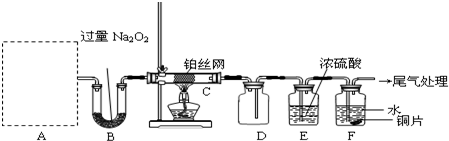
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
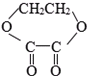 ⑤
⑤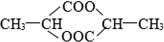 ⑥
⑥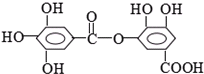
| A、①②⑤ | B、②④⑤ |
| C、②⑤⑥ | D、①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸雨 | B、光化学烟雾 |
| C、温室效应 | D、臭氧空洞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应开始时,溶液中各离子浓度相等 |
| B、达到平衡时,沉淀的速率和溶解的速率相等 |
| C、达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D、达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 气体
气体 A
A| 氧化 |
| 还原 |
| 氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com