分析:(1)有机物燃烧完全燃烧生成CO
2和H
2O,通过足量的石灰水,发生反应:CO
2+Ca(OH)
2=CaCO
3↓+H
2O,得到沉淀20g为CaCO
3质量,根据差量法计算生成碳酸钙的反应中导致溶液质量减少,再结合实际滤液质量减少计算燃烧生成水的质量,确定C、H原子数目之比,据此判断;
(2)令烃及烃的含氧衍生物组成通式为C
xH
yO
z,总物质的量一定时,以任意比混合,有机物完全燃烧消耗氧气的物质的量和生成CO
2的物质的量不变,则化学式中的C原子个数相同,每摩尔有机物耗氧量(x+
-
)mol相同即符合题意;
(3)甲醇、乙二醇、丙三醇分别有1、2、3个羟基,2mol金属钠与2mol羟基反应放出1mol氢气,这三种物质分别与足量金属钠反应产生等体积的氢气,说明三者中羟基物质的量相等,然后求出三种醇的物质的量之比;
(4)丁烯进行醛化反应也可得到醛为戊醛,可以看作-CHO取代丁烷中1个H原子形成,判断丁烷的同分异构体,再根据丁烷中等效氢判断;
(5)H
2、CO在整个过程中发生的化学方程式为:2H
2+O
22H
2O、2Na
2O
2+2H
2O=4NaOH+O
2↑;2CO+O
22CO
2、2Na
2O
2+2CO
2=2Na
2 CO
3+O
2,由反应方程式可知,过氧化钠增加的质量即为H
2、CO的质量.因此只要是CO或H
2或它们的混合气体或化学组成符合(CO)m?(H
2)n满足题意;
(6)某烃A与Br
2发生加成反应生成二溴代物B.B用热的NaOH醇溶液处理得有机物C,经测定C的分子中含有两个双键,其分子式为C
5H
6,将C在催化条件下加氢可得到环戊烷,逆推可知C为
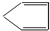
,B为
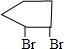
,则A为
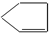
.
解答:
解:(1)有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀20g,应为CaCO
3,
n(CO
2)=n(CaCO
3)=
=0.2mol,
CO
2+Ca(OH)
2=CaCO
3↓+H
2O 滤液减少的质量56
1mol 100g 56g
0.2mol 20g 11.2g
称量滤液时,其质量只比原石灰水减少5.8g,则生成水的质量应为11.2g-5.8g=5.4g,
则n(H)=2n(H
2O)=
×2=0.6mol,
则有机物中N(C):N(H)=0.2mol:0.6mol=1:3,
选项中乙醇中C、H原子数目之比符合1:3,而其它乙烯(C
2H
4)、乙醛(C
2H
4O)、甲酸甲酯(C
2H
4O
2)都不符合,
故选B;
(2)令烃及烃的含氧衍生物组成通式为C
xH
yO
z,总物质的量一定时,以任意比混合,有机物完全燃烧消耗氧气的物质的量和生成CO
2的物质的量不变,则化学式中的C原子个数相同,每摩尔有机物耗氧量(x+
-
)mol相同即符合题意,
A.乙烯、乙醇、乙醛分子式中都含有2个C原子,1mol乙烯耗氧量=(2+
)mol=3mol,1mol乙醇耗氧量=(2+
-
)mol=3mol,1mol乙醛耗氧量=(2+
-
)mol=2.5mol,1mol有机物耗氧量不相等,故A错误;
B.乙炔、乙醛、乙二醇分子式中都含有2个C原子,1mol乙炔耗氧量=(2+
)mol=2.5mol,1mol乙醛耗氧量=(2+
-
)mol=2.5mol,1mol乙二醇耗氧量=(2+
-
)mol=2.5mol,1mol有机物耗氧量相等,故B正确;
C.甲烷、甲醇、乙酸分子中C原子数目分别为1、1、2,C原子数目不相等,故C错误;
D.甲烷、甲酸甲酯、丙二酸分子中C原子数目不相等,故D错误,
故选B;
(3)甲醇、乙二醇、丙三醇分别有1、2、3个羟基,2mol金属钠与2mol羟基反应放出1mol氢气,这三种物质分别与足量金属钠反应产生等体积的氢气,说明三者中羟基物质的量相等,然后求出三种醇的物质的量之比为:1:
:
=6:3:2,
故答案为:6:3:2;
(4)丁烯进行醛化反应也可得到醛为戊醛,可以看作-CHO取代丁烷中1个H原子形成,丁烷有正丁烷、异丁烷两种,正丁烷分子中有2种H原子,-CHO取代正丁烷中1个H原子形成的醛有2种,异丁烷分子中有2种H原子,-CHO取代异丁烷中1个H原子形成的醛有2种,故戊醛共有4种结构,
故答案为:4;
(5)H
2、CO在整个过程中发生的化学方程式为:
2H
2+O
22H
2O 2Na
2O
2+2H
2O=4NaOH+O
2↑;
2CO+O
22CO
2 2Na
2O
2+2CO
2=2Na
2 CO
3+O
2,
由反应方程式可知,过氧化钠增加的质量即为H
2、CO的质量.因此只要是CO或H
2或它们的气体或化学组成符合(CO)m?(H
2)n,则过氧化钠固体增重质量等于原物质的质量,则①②③符合,而HCOOCH
3可以改写成(CO)
2?(H
2)
2,HOOC-COOH可以改写成(CO)
2?(H
2O)
2,故④符合,⑤不符合,
故答案为:①②③④;
(6)某烃A与Br
2发生加成反应生成二溴代物B,A还愿意不饱和键,B用热的NaOH醇溶液处理得有机物C,经测定C的分子中含有两个双键,其分子式为C
5H
6,不饱和度为
=3,还含有1个环,将C在催化条件下加氢可得到分子式为C
5H
10的有机物D,则D为环戊烷,逆推可知C为

,B为

,则A为

,故答案为:

;

;

.

 ,B为
,B为 ,则A为
,则A为 .
. ,B为
,B为 ,则A为
,则A为 ,故答案为:
,故答案为: ;
; ;
; .
.


 阅读快车系列答案
阅读快车系列答案 在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示.请回答下列问题:
在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示.请回答下列问题:
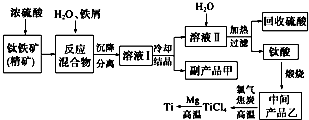 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下: