
【题目】用 NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
B. 235g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]() +
+![]() +10
+10![]() ,净产生的中子(
,净产生的中子(![]() )数为10NA
)数为10NA
C. 丙醇中存在的共价键总数为10NA
D. 50mL 18.4mol·L-1 浓硫酸与足量铜微热反应,生成 SO2 分子数目为 0.46NA
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法,正确的是( )
A.四氧化三铁俗称铁红,可用于作油漆、红色涂料
B.石英可用于制电脑芯片
C.纯碱可用于治疗胃酸过多
D.过氧化钠可用作于潜艇的供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物具有广泛的用途。
(1)Cu2+基态核外电子排布式为__________________。
(2)往硫酸铜溶液中加入过量氨水,溶液最终变成深蓝色,继续加入乙醇,可析出![]() N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
(3)铜的一种氧化物晶体结构如图所示,其中O原子的配位数为_________________。
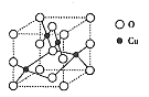
(4) Cu2O的熔点比Cu2S高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含氧原子的物质的量相同的是( )
A. 0.3molO2和0.3molH2O B. 0.1molH2SO4和3.01×1023个H2O
C. 0.1molMgSO4.7H2O和0.1molC12H22O11 D. 6.02×1023个CO2和0.1molKMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
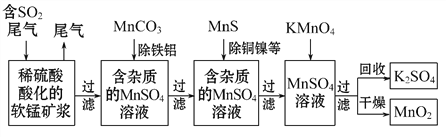
下列说法不正确的是( )
A. 上述流程脱硫实现了废弃物的综合利用和酸雨的减少
B. 用MnCO3能除去溶液中Al3+和Fe3+,其原因是碳酸铝和碳酸铁的溶解度比MnCO3更小。
C. MnO2是碱性锌锰电池的正极材料,碱性锌锰电池放电时,正极的电极反应式是MnO2+H2O+e-MnOOH+OH-
D. 假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将am3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为C mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2为(0.6C-0.4ab)mol

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是海水蒸馏的装置示意图,下列有关海水蒸馏的叙述正确的是( )

A. 本装置缺少温度计,所以无法进行海水蒸馏
B. 海水经过本装置的蒸镏后,锥形瓶中得到的是淡水
C. 装置中冷凝器中水流的方向不对,应该为上口进水,下口出水,便于水流下
D. 海水蒸馏前无须加入沸石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
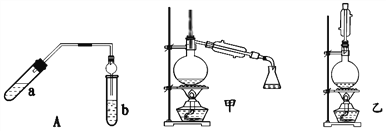
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:_________。
(2)分离出乙酸乙酯层后,经过洗涤杂质;为了干燥乙酸乙酯可选用的干燥剂为______。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(3)为充分利用反应物,该同学又设计了图中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为更合理的是_________________。理由是:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被浓HNO3溶解,反应为:
Cu+4HNO3===Cu(NO3)2+2NO2↑十2H2O。
(1)用双线桥法标出电子转移的方向和数目________________________ 。
(2)上述反应中,氧化剂是______,氧化产物是________,还原剂与还原产物的物质的量之比为________。
(3)若有1mol Cu被氧化,则转移电子的数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com