
【题目】铜的化合物具有广泛的用途。
(1)Cu2+基态核外电子排布式为__________________。
(2)往硫酸铜溶液中加入过量氨水,溶液最终变成深蓝色,继续加入乙醇,可析出![]() N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
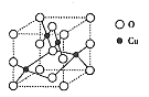
(3)铜的一种氧化物晶体结构如图所示,其中O原子的配位数为_________________。
(4) Cu2O的熔点比Cu2S高的原因是__________________。
【答案】 [Ar]3d9或1s22s22p63s23p63d9 N>O>S CCl4 (CF4、SiF4等合理) 3 4 因为r(O2-)<r(S2-),所以Cu2O的晶格能比Cu2S大,熔点高
【解析】(1)铜的质子数是29,则Cu2+基态核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9。(2)非金属性越强,第一电离能越大,氮元素的2p轨道电子处于半充满状态,稳定性强,第一电离能大于相邻元素,则N、O、S原子的第一电离能由大到小的顺序为N>O>S。原子数和价电子数分别都相等的互为等电子体,则与SO42-互为等电子体的分子的化学式为CCl4、CF4、SiF4等,饱和碳原子均是sp3杂化,羟基氧原子也是sp3杂化,则每个乙醇分子中sp3杂化的原子个数为3个。(3)O原子和铜原子的原子个数分别是8×1/8+6×1/2=4、4,铜原子的配位数是4,则氧原子的配位数也为4;(4)因为r(O2-)<r(S2-),所以Cu2O的晶格能比Cu2S大,熔点高。


科目:高中化学 来源: 题型:
【题目】某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:

“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:

①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素是中枢神经兴奋剂,其合成路线如下图所示。

(1)F中的含氧官能团名称为 ____和_____。
(2)E的结构简式为 ____。
(3)写出B→C的化学反应方程式:_______。
(4) F→G历经两步反应,反应类型依次为_____、 ______。
(5)请写出同时满足下列条件的F的一种同分异构体的结构简式_____。
①能发生银镜反应;②水解产物能与FeCl3显色:③核磁共振氢谱显示有四组峰。
(6)请写出以乙醇为原料制备强吸水性树脂![]() 的合成路线流程图(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)___________________。
的合成路线流程图(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+, 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作是___________,(填操作名称)需用到的玻璃仪器除烧杯外还有___________, ___________。
(2)步骤2中发生反应的离子方程式为______________________________
(3)步骤3中发生反应的化学方程式为______________________________
(4)步骤4中涉及的操作是:蒸发浓缩、________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、盐酸和K2CO3三种 试剂,按如下步骤操作:

(1)图中三种试剂分别为:A__________________、 B__________________、 C___________________。
(2)加入过量A的目的是______________________________________________________________________;
加入过量B的目的是______________________________________________________________________;
加热煮沸的目的是______________________________________________________________________;
(3)操作Ⅱ的名称是______________________________。
(4)检验得到的KCl中不含有SO42-的操作________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. pH计不能用于酸碱中和滴定终点的判断
B. 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
C. 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
D. 氯离子存在时,铝表面的氧化膜易被破坏,故含盐腌制品不宜直接放在铝制容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
B. 235g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]() +
+![]() +10
+10![]() ,净产生的中子(
,净产生的中子(![]() )数为10NA
)数为10NA
C. 丙醇中存在的共价键总数为10NA
D. 50mL 18.4mol·L-1 浓硫酸与足量铜微热反应,生成 SO2 分子数目为 0.46NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。下列说法错误的是
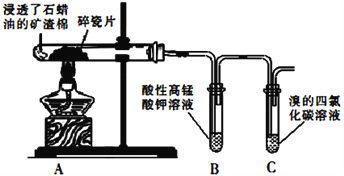
A. 碎瓷片有催化和积蓄热量的作用 B. 试管B、C中溶液均褪色,反应类型不相同
C. 石蜡油与煤焦油的组成相同 D. 结束反应时,先撤出导管,再停止加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com