
【题目】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、盐酸和K2CO3三种 试剂,按如下步骤操作:

(1)图中三种试剂分别为:A__________________、 B__________________、 C___________________。
(2)加入过量A的目的是______________________________________________________________________;
加入过量B的目的是______________________________________________________________________;
加热煮沸的目的是______________________________________________________________________;
(3)操作Ⅱ的名称是______________________________。
(4)检验得到的KCl中不含有SO42-的操作________________________________________
【答案】Ba(OH)2K2CO3盐酸除尽Mg2+和SO42-除尽过量的Ba2+使过量的HCl挥发蒸发取KCl固体少许于试管中,滴加蒸馏水溶解,先滴加稀盐酸再滴加氯化钡溶液,若不产生白色沉淀,则证明不含有硫酸根离子
【解析】
为了除去MgCl2、MgSO4应加入过量的Ba(OH)2,充分反应后生成Mg(OH)2沉淀和BaSO4沉淀,KCl中仍含有BaCl2和过量的Ba(OH)2,再向体系中加入过量的K2CO3除去BaCl2和过量的Ba(OH)2,充分反应后过滤,所得滤液中含有KCl、KOH和过量的K2CO3;最后向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,将溶液加热煮沸使过量的HCl挥发获得KCl溶液,将KCl溶液蒸发获得KCl固体。根据以上分析回答(1)~(3)。用稀盐酸和BaCl2溶液检验SO42-。
为了除去MgCl2、MgSO4应加入过量的Ba(OH)2,充分反应后生成Mg(OH)2沉淀和BaSO4沉淀,KCl中仍含有BaCl2和过量的Ba(OH)2,再向体系中加入过量的K2CO3除去BaCl2和过量的Ba(OH)2,充分反应后过滤,所得滤液中含有KCl、KOH和过量的K2CO3;最后向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,将溶液加热煮沸使过量的HCl挥发获得KCl溶液,将KCl溶液蒸发获得KCl固体。
(1)根据上述分析,图中三种试剂,A为Ba(OH)2,B为K2CO3,C为盐酸。
(2)加入过量A的目的是除尽Mg2+和SO42-,加入A发生的反应为MgCl2+Ba(OH)2=Mg(OH)2↓+BaCl2、MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓。加入过量B的目的是除尽过量的Ba2+,发生的反应为BaCl2+K2CO3=BaCO3↓+2KCl、Ba(OH)2+K2CO3=BaCO3↓+2KOH。向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,加热煮沸的目的是使过量的HCl挥发。
(3)从KCl溶液中获得KCl固体的操作为蒸发,操作II的名称是蒸发。
(4)用稀盐酸和BaCl2溶液检验SO42-。检验得到的KCl中不含SO42-的操作:取KCl固体少许于试管中,滴加蒸馏水溶解,先滴加稀盐酸再滴加氯化钡溶液,若不产生白色沉淀,则证明不含有SO42-。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】标准状况下有 ① 0.2 mol NH3 ②25.6 gSO2气体 ③3.01×1023个氯化氢分子 ④6.72L甲烷。下列对这四种气体的关系从小到大表示不正确的是
A. 体积:①<④<②<③ B. 密度: ①<④<③<②
C. 质量:①<④<③<② D. 原子数:①<③<②<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属混合物3.4g,与足量的盐酸反应放出H22.24L(标况下),这两种金属可能是
A. 铜和铁 B. 镁和铝 C. 锌和铝 D. 锌和铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得千燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测不正确的是 ( )
A. K+一定存在 B. Ba2+、Mg2+一定不存在
C. Cl- 一定存在 D. 混合溶液中CO32-的浓度为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物具有广泛的用途。
(1)Cu2+基态核外电子排布式为__________________。
(2)往硫酸铜溶液中加入过量氨水,溶液最终变成深蓝色,继续加入乙醇,可析出![]() N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
(3)铜的一种氧化物晶体结构如图所示,其中O原子的配位数为_________________。
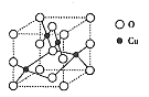
(4) Cu2O的熔点比Cu2S高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1.06g Na2CO3溶于水配成100ml溶液,求:
(1)Na2CO3溶液的物质的量浓度;________________
(2)Na+ 物质的量浓度; ______________
(3)取出20.0ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求稀释后溶液的体积。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
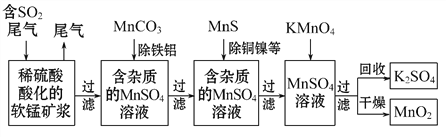
下列说法不正确的是( )
A. 上述流程脱硫实现了废弃物的综合利用和酸雨的减少
B. 用MnCO3能除去溶液中Al3+和Fe3+,其原因是碳酸铝和碳酸铁的溶解度比MnCO3更小。
C. MnO2是碱性锌锰电池的正极材料,碱性锌锰电池放电时,正极的电极反应式是MnO2+H2O+e-MnOOH+OH-
D. 假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将am3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为C mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2为(0.6C-0.4ab)mol

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是

A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =4.2,则Ka2(H2A)的数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com