
【题目】下列说法正确的是( )
A. pH计不能用于酸碱中和滴定终点的判断
B. 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
C. 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
D. 氯离子存在时,铝表面的氧化膜易被破坏,故含盐腌制品不宜直接放在铝制容器中
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)判断BaCl2已过量的方法是__________________________________。
(2)第④步中,相关的化学方程式是_________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20 mL0.1000 mol/L H2C2O4溶液中滴加0.1000 mol·L-1NaOH溶液,混合溶液pH随加入NaOH溶液体积的变化如图所示。下列有关叙述正确的是
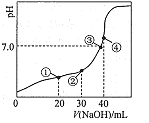
A. 点①、③、④所示溶液中,点③所示溶液H2O的电离程度最小
B. 点②所示溶液中:![]()
C. 点③所示溶液中:![]()
D. 滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物具有广泛的用途。
(1)Cu2+基态核外电子排布式为__________________。
(2)往硫酸铜溶液中加入过量氨水,溶液最终变成深蓝色,继续加入乙醇,可析出![]() N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
N、O、S原子的第一电离能由大到小的顺序为__________________,与SO42-互为等电子体的分子的化学式为__ ,每个乙醇分子中sp3杂化的原子个数为_________________。
(3)铜的一种氧化物晶体结构如图所示,其中O原子的配位数为_________________。
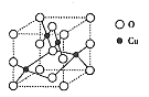
(4) Cu2O的熔点比Cu2S高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列既是氧化还原反应,又是吸热反应的是
A.灼热的炭与水蒸气的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.铝片与稀盐酸反应D.甲烷(CH4)在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含氧原子的物质的量相同的是( )
A. 0.3molO2和0.3molH2O B. 0.1molH2SO4和3.01×1023个H2O
C. 0.1molMgSO4.7H2O和0.1molC12H22O11 D. 6.02×1023个CO2和0.1molKMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是海水蒸馏的装置示意图,下列有关海水蒸馏的叙述正确的是( )

A. 本装置缺少温度计,所以无法进行海水蒸馏
B. 海水经过本装置的蒸镏后,锥形瓶中得到的是淡水
C. 装置中冷凝器中水流的方向不对,应该为上口进水,下口出水,便于水流下
D. 海水蒸馏前无须加入沸石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)判断反应达到平衡状态的依据是______(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。


(3)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______。
(4)写出该反应的热化学方程式______________________________。
(5)当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(6)恒容条件下,下列措施中能使![]() 增大的有______.
增大的有______.
A.升高温度 B.充入He气
C.再充入1molCO和2molH2 D.使用催化剂
(7)在恒温条件下,扩大容器体积,则平衡____(填“逆向移动”、“正向移动”、“不移动”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com