
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)判断反应达到平衡状态的依据是______(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。


(3)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______。
(4)写出该反应的热化学方程式______________________________。
(5)当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(6)恒容条件下,下列措施中能使![]() 增大的有______.
增大的有______.
A.升高温度 B.充入He气
C.再充入1molCO和2molH2 D.使用催化剂
(7)在恒温条件下,扩大容器体积,则平衡____(填“逆向移动”、“正向移动”、“不移动”)
【答案】 c d < = 升温 v(CO)= 0.075mol·L-1·min-1 CO(g) +2H2(g) ![]() CH3OH(g) ΔH= -91 kJ·mol-1 减小 C 逆向移动
CH3OH(g) ΔH= -91 kJ·mol-1 减小 C 逆向移动
【解析】(1)生成CH3OH的速率与消耗CO的速率都是正反应速率,无法判断是否达到平衡状态,a错误;反应前后气体的总质量不变,容器容积固定,气体的体积不变,气体的密度恒为定值,不能判断反应是否达到平衡,b错误;反应前后都是气体,化学计量数之和不相等,故混合气体的总物质的量不变,可以判断达到了平衡状态,c正确;反应物和生成物的浓度不变,生成速率等于消耗速率,正逆反应速率相等,达到了平衡状态,d正确;正确选项cd。
(2)根据图2,A、C两点温度相同,C点的压强大于A点,故反应速率:A<C;因为温度相同,故A、C的化学平衡常数相等;B点氢气的含量小于A点的,反应放热,若要提高氢气的含量,必须升高温度;正确答案:![]() ;=;升温。
;=;升温。
(3)根据图像可知:CO浓度变化=1-0.25=0.75mol/L;平均反应速率v(CO)=0.75/10=0.075mol·L-1·min-1;正确答案:0.075mol·L-1·min-1。
(4)根据图像可知该反应的ΔH=反应物断键吸收的总能量-生成物成键放出的总能量=419-510=-91 kJ·mol-1 ;该反应的热化学方程式CO(g) +2H2(g) ![]() CH3OH(g) ΔH= -91 kJ·mol-1;正确答案:CO(g) +2H2(g)
CH3OH(g) ΔH= -91 kJ·mol-1;正确答案:CO(g) +2H2(g) ![]() CH3OH(g) ΔH= -91 kJ·mol-1。
CH3OH(g) ΔH= -91 kJ·mol-1。
(5)CO(g) +2H2(g) ![]() CH3OH(g) ΔH= -91 kJ·mol-1,反应为放热反应,升高温度,平衡左移,该平衡常数K将减小;正确答案:减小。
CH3OH(g) ΔH= -91 kJ·mol-1,反应为放热反应,升高温度,平衡左移,该平衡常数K将减小;正确答案:减小。
(6)升高温度,平衡左移,![]() 减小,A 错误;体积、温度不变,充入He气,对各物质的浓度没有影响,平衡不动,因此
减小,A 错误;体积、温度不变,充入He气,对各物质的浓度没有影响,平衡不动,因此![]() 不变,B错误;恒容条件下,再充入1molCO和2molH2,相当于增大容器内气体的压强,平衡右移,
不变,B错误;恒容条件下,再充入1molCO和2molH2,相当于增大容器内气体的压强,平衡右移,![]() 增大,C正确;使用催化剂只能改变反应的速率,平衡不移动,
增大,C正确;使用催化剂只能改变反应的速率,平衡不移动,![]() 不变,D错误;正确选项C。
不变,D错误;正确选项C。
(7)在恒温条件下,扩大容器体积,相当于减小压强,平衡向气体体积增大的方向移动,则平衡逆向移动;正确答案:逆向移动。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. pH计不能用于酸碱中和滴定终点的判断
B. 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
C. 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
D. 氯离子存在时,铝表面的氧化膜易被破坏,故含盐腌制品不宜直接放在铝制容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在盛有溴水的三支试管中分别加入酒精、四氯化碳和苯,振荡后静置,出现下列现象,正确的结论是( )

A. ①加了CCl4 ②加了苯 ③加了酒精
B. ①加了苯 ②加了CCl4 ③加了酒精
C. ①加了酒精 ②加了CCl4 ③加了苯
D. ①加了苯 ②加了酒精 ③加了CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。下列说法错误的是
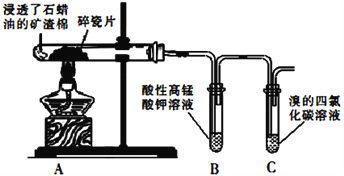
A. 碎瓷片有催化和积蓄热量的作用 B. 试管B、C中溶液均褪色,反应类型不相同
C. 石蜡油与煤焦油的组成相同 D. 结束反应时,先撤出导管,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
A. 达平衡时间甲比乙短
B. 乙容器中再充入等物质的量的SO2和O2,重新达平衡时转化率减小
C. 达平衡时,甲中SO2的浓度比乙中SO2的浓度大
D. 达平衡时,甲的转化率比乙低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是

A. 开始时左右两室分子数相同
B. 最终容器内无H2存在
C. 反应前后H2室压强相同
D. 最终容器内密度与原来相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: (已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
 请回答下列问题:
请回答下列问题:
(1)操作①加热的目的是________________
(2)操作②除用BaCl2溶液外,还可用________。
(3)操作②,判断SO42-已除尽的方法是_____________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是_________。
(5)操作④的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,H2CO3 Ka1=4.2×10-7,Ka2=5.6×10-11;某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(a)随溶液pH 变化关系如下图所示,下列叙述错误的是
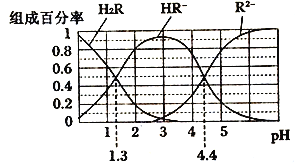
A. 在pH=4.4 的溶液中:3c(HR-)=c(Na+)+c(H+)-c(OH-)
B. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R==2HCO3-+R2-
C. 等体积等浓度的NaOH 溶液与H2R溶液混合,所得溶液中水的电离程度比纯水大
D. 在pH=3 的溶液中,三种微粒的浓度满足关系式: c(R2-)c(H2R)/c(HR-)2=10-3.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法不正确的是( )
A.Fe2O3俗称铁红
B.用FeCl3溶液作刻制印刷电路的“腐蚀液”
C.常温下可用铁制容器盛装浓硫酸或浓硝酸
D.水蒸气通过灼热的铁粉生成氢氧化铁和氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com