
【题目】气凝胶是一种世界上最轻的固体,世被称为“固态烟”,非常坚固耐用,它可以承受相当于自身重量几千倍的压力,最高能承受1400摄氏度的高温,绝热性能十分优越,其主要成分是二氧化硅等。下列说法正确的是( )
A. 该材料具有良好的导电性
B. 二氧化硅可用于制作光导纤维
C. 二氧化硅耐所有的酸和碱
D. 水泥的主要成分是二氧化硅
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:
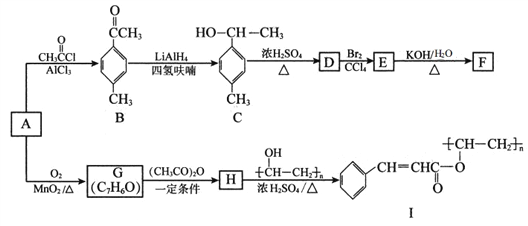
(1)A的分子式为____________,上述八个反应中,属于取代反应的共有_______个。
(2) D的名称为____________________,G分子中最多有_________个原子共面。
(3)由H生成I的化学方程式为_____________________________________________。
(4)符合下列条件的B的同分异构体有____________种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是_________(写出其中一种的结构简式)。
①属于芳香化合物;②能发生银镜反应。
(5)己知![]() ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备 ![]() 的合成路线___________________________________。
的合成路线___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
A. 乙元素的族序数比甲元素的族序数大
B. 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙
C. 原子半径的大小:甲>乙
D. 含乙元素的化合物数目比含甲或丙元素的化合物数目多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化主要生成CO、H2等,其中CO、H2是用途相当广泛的化工基础原料。但煤的气化获得的化工原料气中常含有少量羰基硫(COS),能引起催化剂中毒、大气污染等。
(1)COS的电子式为_____________________。
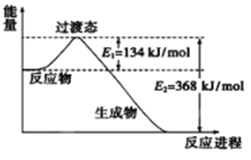
(2)下图是1molCO和lmolNO2反应生成两种气态氧化物过程屮能量变化示意图。已知14克CO参加反应时转移电子数为NA。写出该反应的热化学方程式_______________________。
(3)在某一恒温、恒容的密闭容器中发生以下反应:Ni(S)+4CO(g) ![]() Ni(CO)4(g)。下列说法正确的是__________。
Ni(CO)4(g)。下列说法正确的是__________。
A.该反应的反应热△H<0
B.增加Ni的量可提高CO的转化率,Ni的转化率降低
C.反应达到平衡后,充入CO再次达到平衡时,CO的浓度增大
D.当v正[Ni(CO)4]=4v逆(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衝状态
(4)工业上采用CO与H2反应合成甲醇,反应如下CO(g)+2H2(g)![]() CH3OH(g)。在T℃时,将2molCO和amolH2充入2L的恒容密闭容器中充分反应,l0min后反应达到平衡。已知v(CH3OH)=0.05molL-1min-1,且CO和H2的转化率相等。
CH3OH(g)。在T℃时,将2molCO和amolH2充入2L的恒容密闭容器中充分反应,l0min后反应达到平衡。已知v(CH3OH)=0.05molL-1min-1,且CO和H2的转化率相等。
①H2的转化率为_________________,反应未开始时的容器内气体压强P1与反应达平衡时压强P2的比值为__________________。
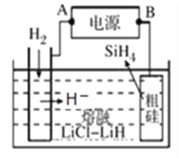
②以甲醇燃料电池为电源,熔融盐电解法制取硅烷原理如图。阳极的电极反应式为_______________。
(5)甲醇可制备二甲醚:2CH3OH(g)![]() CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。
CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。
①在300℃时,测得n(CH3OCH3)=2n(CH3OH),此时反应的v正__________v逆(填“〉”、“〈”或“=”〉,你的分析理由是___________________。
②二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×l05Pa测定):
Ⅰ:CH3OCH3(g)+H2O(1)![]() 2CH3OH(1)△H>0
2CH3OH(1)△H>0
Ⅱ:CH3OH(1)+H2O(1)![]() CO2(g)+3H2(g)△H>0
CO2(g)+3H2(g)△H>0
Ⅲ:CO(g)+H2O(1)![]() CO2(g)+H2(g)△H<0
CO2(g)+H2(g)△H<0
Ⅳ:CH3OH(l)![]() CO(g)-2H2(g)△H>0
CO(g)-2H2(g)△H>0
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,
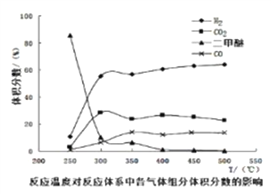

你认为反应控制的最佳温度应为__________。
A. 300350℃ B. 35040℃ C. 400450℃ D. 450500℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物结构、性质的说法正确的是( )
A. 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化
B. 乙酸乙酯和油脂互为同系物
C. 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应
D. 蔗糖、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、技术密切关。下列说法错误的是
A. “疫苗”等生物制剂需要冷冻保存 B. 明矾和二氧化氯处理水,原理相同
C. 用氢氟酸可进行玻璃雕刻 D. 小苏打和氢氧化铝均可用于中和胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下图为相互串联的三个装置,试回答:
![]()

(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com