
【题目】下列关于有机物结构、性质的说法正确的是( )
A. 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化
B. 乙酸乙酯和油脂互为同系物
C. 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应
D. 蔗糖、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】化学蚀刻法是指用化学药品在一些固体材料表面腐蚀出图案的方法。下列蚀刻方法可行的是( )
A. 用氢氟酸蚀刻玻璃
B. 用浓HNO3蚀刻水晶
C. 用FeCl2溶液蚀刻铜板
D. 用Na2CO3溶液蚀刻大理石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业烧碱中常含有少量NaCl。为测定烧碱中NaOH的质量分数,称取1.6g样品与19.00mL、2.0molL—1盐酸恰好反应。
(1)求所消耗盐酸中HCl的物质的量_____________
(2)求工业烧碱中NaOH的纯度_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气凝胶是一种世界上最轻的固体,世被称为“固态烟”,非常坚固耐用,它可以承受相当于自身重量几千倍的压力,最高能承受1400摄氏度的高温,绝热性能十分优越,其主要成分是二氧化硅等。下列说法正确的是( )
A. 该材料具有良好的导电性
B. 二氧化硅可用于制作光导纤维
C. 二氧化硅耐所有的酸和碱
D. 水泥的主要成分是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A.实验①中,若5 min时测得n(M) =0.05 mol,则0至5 min时间内,用N表示的平均反应速率v(N) =
0.01 mol/( L·min)
B.实验②中,该反应的平衡常数K=1.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.06
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示: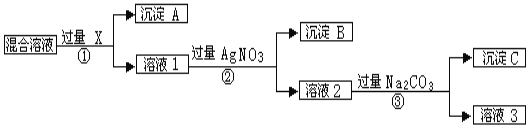
请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X_____________,沉淀A____________,沉淀B______________;
(2)上述实验流程中加入过量的Na2CO3的目的是____________________________。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是__________________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25℃),则下列说法(或关系式)正确的是( )
A. c(Na+)﹣c(X-)=9.9×10-7mol/L
B. c(Na+)= c(X-)+c(HX)= 0.2mol/L
C. 混合溶液中由水电离出的c(OH-)= 1×10-8mol/L
D. c(OH-)﹣c(HX)= c(H+)=1×l0-6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某未知溶液中已检验出含有离子Ca2+、NO3-,且pH=2。欲检验此溶液中是否大量存在以下6种离子:①ClO- ②NH4+ ③I- ④Fe2+ ⑤AlO2- ⑥Cl-,其中不必检验就能排除的离子是
A.②③⑤⑥ B.①③④⑤
C.①④⑤⑥ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
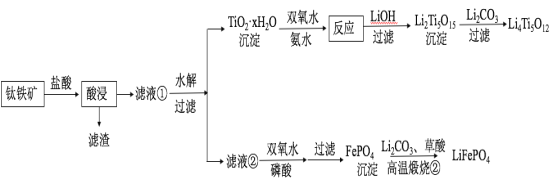
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com