
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
|
| A. | 常温常压下,14 g CO中含有的原子数目为NA |
|
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA |
|
| C. | 25℃时,pH=13的1.0 L的Ba(OH)2溶液中含有的OH﹣数目为0.2 NA |
|
| D. | 1L1mol•L﹣1的NaClO 溶液中含有ClO﹣的数目为NA |
| 阿伏加德罗常数. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | A.一氧化碳为双原子分子,14g一氧化碳的物质的量为0.5mol,含有1mol原子; B.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,0.1mol氯气反应转移了0.1mol电子; C.pH=13的溶液中氢氧根离子的浓度为0.1mol/L,根据n=cV计算出氢氧根离子的物质的量; D.次氯酸钠溶液中,次氯酸根离子部分水解,溶液中次氯酸根离子数目减少. |
| 解答: | 解:A.14g CO的物质的量为0.5mol,0.5molCO中含有1mol原子,含有的原子数目为NA,故A正确; B.标况下2.24L氯气的物质的量为0.1mol,0.1mol氯气反应转移了0.1mol电子,转移的电子总数为0.1NA,故B错误; C.pH=13的溶液中氢氧根离子的浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH﹣数目为0.1NA,故C错误; D.1L1mol•L﹣1的NaClO 溶液中含有1mol溶质次氯酸钠,由于次氯酸根离子部分水解,则溶液中次氯酸根离子小于1mol,含有ClO﹣的数目小于NA,故D错误; 故选A. |
| 点评: | 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确氯气与氢氧化钠溶液、过氧化钠与水的反应中,氯气、过氧化钠既是氧化剂、也是还原剂. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A+B→X+Y+ H2O(为配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是
.
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是______.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z属于同一主族,三种元素可以形成原子个数比为1:1:1的化合物W。下列推测正确的是
A.元素Z的氧化物一定属于碱性氧化物
B.原子半径关系是:X<Y<Z
C.三种元素中,Y的金属性最强
D.Y、Z都能形成含氧酸,且前者的酸性比后者酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
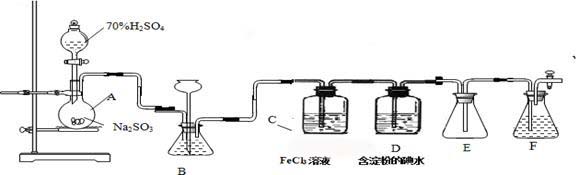
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____ ,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是__________________________,
写出有关离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的是( )
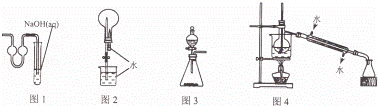
|
| A. | 用图1装置作为制取二氧化碳的尾气吸收装置 |
|
| B. | 用图2装置进行二氧化碳喷泉实验 |
|
| C. | 用图3装置进行二氧化锰和浓盐酸制取氯气的实验 |
|
| D. | 用图4装置进行石油的分馏实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,X、Y与Z不同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z.
(1)Q的最高价氧化物,其固态属于 分子 晶体,俗名叫 干冰 ;
(2)R的氢化物分子的空间构型是 正四面体 ,属于 非极性 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是 Si3N4 ;
(3)X的常见氢化物的空间构型是 三角锥型 ;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是  ;
;
(4)Q分别与Y、Z形成的共价化合物的化学式是 CS2 和 CCl4 ;Q与Y形成的分子的电子式是 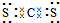 ,属于 非极性 分子(填“极性”或“非极性”).
,属于 非极性 分子(填“极性”或“非极性”).
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是 ( )



|


|
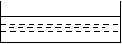 C、a为正极,是碳棒,烧杯中的溶液为硫酸
C、a为正极,是碳棒,烧杯中的溶液为硫酸
D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.除去Cu2+中的少量Fe3+,可加入CuO
B.沸点:晶体硅 > SiO2 > SiCl4 > NaCl
C.Cu(NH3)42+中的配位键是由Cu2+提供孤对电子,NH3提供空轨道形成的
D.石油的分馏、煤的液化以及煤的干馏等生产过程中均只发生物理变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com