
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法不正确的是

A.通过该催化反应,实现了太阳能向化学能的转化
B.反应I中涉及到非极性键的断裂和极性键的形成
C.反应II为:2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D.总反应为:2H2O 2H2↑+O2↑
2H2↑+O2↑
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃的球棍模型如图所示:
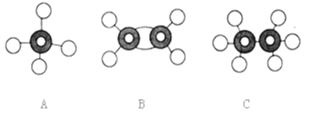
(1)A、B、C的分子式分别是________、________、________;
(2)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测反应前后气体体积,没有发生变化,这两种气态烃是________;
(3)写出B转化为C的化学方程式:_________________________________________________;
(4)除去气体C中混有的少量B可选用的试剂名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为_______,该能层的原子轨道数有_____ 个。下列有关表示基态氮原子的电子排布图中,仅违背洪特规则的是________(填字母)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)氮的一种氢化物 N2H4 是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4 ℃、113.5 ℃,氨气的熔点、沸点分别为-77.7 ℃、-33.5 ℃。
①N2H4中氮原子的杂化轨道类型为_______杂化。
②H2O的VSEPR模型为______。
③肼与氨气熔点、沸点差异最主要的原因是_________________。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有___________ (填序号)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(4)已知[Co(NH3)6]3+的几何构型为正八面体形,推测[CoCl3(NH3)3]结构有__________种。
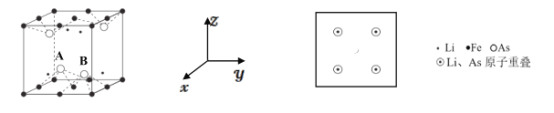
(5)LiFeAs可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为 a nm,A、B 处的两个As原子之间距离=______nm,请在z轴方向投影图中画出铁原子的位置,用“ ”表示__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)写出实验室制NH3的化学方程式_________________;
(2)写出铅蓄电池的负极电极反应式__________________;
(3)写出Ba(OH)2·8H2O与NH4Cl晶体搅拌反应的化学方程式_______________;
(4)画出稀有气体氪的原子结构示意图__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的原子结构如下表:
元素 编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素名称:________,元素Y的最简单氢化物的结构式为___________;
(2)Z元素原子的质量数为________;
(3)X和Z两种元素的简单离子,离子半径大的是________(填离子符号),X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为_____________;
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为_________________,若反应过程中转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为__________;
(5)写出Z2O2的电子式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 在水玻璃溶液中通入少量CO2:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
B. 向0.1L5mol·L-1亚硫酸氢铵溶液中逐滴加入0.1L7mol·L-1 NaOH溶液:2NH![]() +5HSO3-+7OH-===2NH3·H2O+5SO
+5HSO3-+7OH-===2NH3·H2O+5SO![]() +5H2O
+5H2O
C. Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
D. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=AlO2-+2H2O+4NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某恒容密闭容器中进行反应X(g) + 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A. c1:c2 = 1:3
B. 当4v(X)正= v(Y)逆时,该反应还在向正反应方向建立平衡
C. c1可能为0.1
D. X、Y的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期科学家报告了一种直接电化学合成H2O2的方法,装置如图。下列叙述不正确的是( )
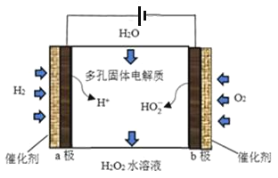
A.该装置的工作原理是将化学能转化成电能
B.b极发生的电极反应为O2+H2O+2e-=HO2-+OH-
C.电池工作时,内部发生反应:HO2-+OH-+2H+=H2O2+H2O
D.电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com