
【题目】氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为_______,该能层的原子轨道数有_____ 个。下列有关表示基态氮原子的电子排布图中,仅违背洪特规则的是________(填字母)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)氮的一种氢化物 N2H4 是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4 ℃、113.5 ℃,氨气的熔点、沸点分别为-77.7 ℃、-33.5 ℃。
①N2H4中氮原子的杂化轨道类型为_______杂化。
②H2O的VSEPR模型为______。
③肼与氨气熔点、沸点差异最主要的原因是_________________。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有___________ (填序号)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(4)已知[Co(NH3)6]3+的几何构型为正八面体形,推测[CoCl3(NH3)3]结构有__________种。
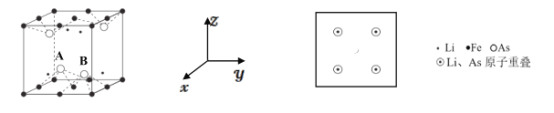
(5)LiFeAs可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为 a nm,A、B 处的两个As原子之间距离=______nm,请在z轴方向投影图中画出铁原子的位置,用“ ”表示__________。
【答案】N 16 B sp3 四面体形 N2H4分子间氢键数目多于NH3分子间氢键数目 BC 2 ![]()

【解析】
(1)As原子序数是33,位于元素周期表第四周期第VA,根据能层序号判断;结合每个能层具有的能级种类及各种能级具有的轨道数目确定;根据原子核外电子排布遵循的规律分析判断;
(2)根据价层电子对互斥理论判断N2H4的杂化轨道类型及H2O的VSEPR模型;结合分子之间的分子间作用力和氢键的数目分析;
(3)配体与中心离子之间存在配位键,配体分子中存在共价键;据此分析;
(4)[Co(NH3)6]3+的几何构型为正八面体形,Co3+位于正八面体几何中心,6个NH3分别位于正八面体形的6个顶点上,其中3个NH3换为Cl-就得到[CoCl3(NH3)3];
(5)根据LiFeAs晶胞中各个原子的相对位置分析解答。
(1)As原子序数是33,位于元素周期表第四周期第VA,原子核外具有四个能层,核外电子排布时按能层能量由低到高顺序排列依次是K、L、M、N、O、P、Q,所以基态砷原子中核外电子占据最高能层的符号为N;第四能层含有4s、4p、4d、4f四种能级,各种能级分别含有的轨道数目为1、3、5、7,所以该能层的原子轨道数有1+3+5+7=16个;
A.2s轨道的能量比2p轨道的能量低,![]() 违背能量最低原理,A不符合题意;
违背能量最低原理,A不符合题意;
B.电子在同一能级不同的原子轨道上排布时,电子总是尽可能分占不同的原子轨道且自旋方向相同,![]() 违背洪特规则,B符合题意;
违背洪特规则,B符合题意;
C. ![]() 遵循核外电子排布规律,C不符合题意;
遵循核外电子排布规律,C不符合题意;
D.同一轨道上不可能存在自旋方向相同的电子,![]() 违背泡利原理,D不符合题意;
违背泡利原理,D不符合题意;
故答案选B;
(2)①在N2H4中N原子形成3个σ键且N原子上还有1对孤电子对,价层电子对数是4,所以N原子杂化轨道类型是sp3杂化;
②H2O中O原子价层电子对数为2+![]() =4,所以其VSEPR模型为四面体形;
=4,所以其VSEPR模型为四面体形;
③N2H4、NH3都是由分子构成的分子晶体,在分子之间都存在分子间作用力,由于都含有N—H键,N元素的非金属性强、原子半径小,所以二者的分子之间还都存在氢键,增加了分子间作用力,但由于N2H4分子间氢键数目多于NH3分子间氢键数目,所以克服氢键和分子间作用力使物质熔化、气化需要较高的能量,因此肼的熔点、沸点比氨气高;
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中NH3与Co3+之间存在配位键;在NH3中N、H原子之间存在极性共价键N-H键,所以[Co(NH3)6]3+中的化学键有配位键、极性共价键,答案选BC;
(4)[Co(NH3)6]3+为正八面体,Co3+位于正八面体几何中心,其中一个NH3分子换成Cl-后结构中有2种位置不同NH3,所以若将[Co(NH3)6]3+中的3个NH3换成Cl-,就得到2种不同结构的[CoCl3(NH3)3];
(5)根据晶胞示意图可知晶胞中含有4个As原子,4个As原子构成一个正四面体,A、B两个As原子之间距离为面对角线长度的一半,由于晶胞参数为 a nm,则面对角线长度为![]() a nm,所以A、B两个As原子之间距离=
a nm,所以A、B两个As原子之间距离=![]() nm;在该晶体中Li、As原子在span>z轴方向投影重叠,Fe原子位于晶胞的8个顶点、8个棱心和2个面心,Fe原子在z轴方向投影位于顶点上、棱中心和面心上,投影示意图为
nm;在该晶体中Li、As原子在span>z轴方向投影重叠,Fe原子位于晶胞的8个顶点、8个棱心和2个面心,Fe原子在z轴方向投影位于顶点上、棱中心和面心上,投影示意图为 。
。


科目:高中化学 来源: 题型:
【题目】2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺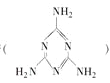 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是
A. 所有碳原子采用sp3杂化,所有氮原子采用sp3杂化
B. 一个分子中共含有15个σ键
C. 属于极性分子,故极易溶于水
D. 分子内既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
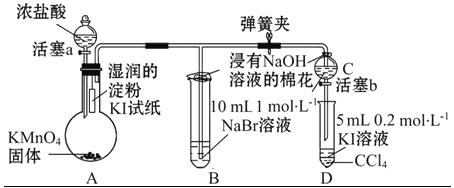
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_________________。
(2)验证氯气的氧化性强于碘的实验现象是_____________________________。
(3)B中溶液发生反应的离子方程式是_________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是
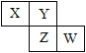
A. 原子半径:Z > Y > XB. 氢化物稳定性:X > Y
C. 氢化物沸点:Z > YD. 最高价氧化物对应的水化物酸性:W > Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )

A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从制溴苯的实验中分离出FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是

A.用装置甲制取氯气按图示通入装置乙中能使Br-全部转化为溴单质
B.用装置丙分液时先从下口放出水层,换一容器从上口倒出有机层
C.检验溶液中是否氧化完全,取水层少许滴加硝酸银溶液,看有无沉淀生成
D.用装置丁将分液后的水层溶液蒸发至有大量晶体析出时,停止加热,余热蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是( )

A.电池工作时,实现了将太阳能转化为电能
B.电池内 H+ 透过质子交换膜从左向右移动
C.铜电极为正极,电极反应式为CO2+8H+-8e-=CH4+2H2O
D.为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法不正确的是

A.通过该催化反应,实现了太阳能向化学能的转化
B.反应I中涉及到非极性键的断裂和极性键的形成
C.反应II为:2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D.总反应为:2H2O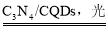 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为___________;x为___________。
(2)若反应经2min达到平衡,平衡时C的浓度___________0.8mol/L(填“大于”、“小于”或“等于”)
(3)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0。请用P0、P来表示达平衡时反应物A的转化率a(A)为___________。
(4)能加快反应速率的措施是___________。
①升高温度
②容器体积不变,充入隋性气体Ar
③容器压強不变,充入惰性气体Ar
④使用催化剂
⑤将容器体积缩小一半
(5)能够说明该反应达到平衡的标志是___________。
A. 容器内混合气体的密度保持不变
B. 容器内混合气体的压强保持不变
C. A、B的浓度之比为3:1
D. 单位时间内断开3nmolA-A键的同时生成nmolB-B键
E. v(A)=3v(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com