
【题目】一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为___________;x为___________。
(2)若反应经2min达到平衡,平衡时C的浓度___________0.8mol/L(填“大于”、“小于”或“等于”)
(3)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0。请用P0、P来表示达平衡时反应物A的转化率a(A)为___________。
(4)能加快反应速率的措施是___________。
①升高温度
②容器体积不变,充入隋性气体Ar
③容器压強不变,充入惰性气体Ar
④使用催化剂
⑤将容器体积缩小一半
(5)能够说明该反应达到平衡的标志是___________。
A. 容器内混合气体的密度保持不变
B. 容器内混合气体的压强保持不变
C. A、B的浓度之比为3:1
D. 单位时间内断开3nmolA-A键的同时生成nmolB-B键
E. v(A)=3v(B)
【答案】0.2mol/(L.min). 2 小于 ![]() ×100% ①④⑤ BD
×100% ①④⑤ BD
【解析】
根据浓度的变化除以时间计算反应速率;容积固定的密闭容器中,容器内气体的压强之比等于它们的物质的量之比;升高温度、增加浓度、使用催化剂能加快反应速率;平衡状态的判断抓住正反应速率等于逆反应速率和各组分的浓度不再改变来进行判断。
(1)反应1min时测得剩余1.8molA,则A反应了3mol -1.8mol=1.2 mol,根据方程式,B反应了0.4mol,B的浓度变化为![]() ,则1min内,B的平均反应速率为
,则1min内,B的平均反应速率为![]() ;C的浓度为0.4mol/L,C的浓度是B浓度变化的2倍,则x为2;
;C的浓度为0.4mol/L,C的浓度是B浓度变化的2倍,则x为2;
(2)若反应经2min达到平衡,开始1min时A、B的浓度较大,反应速率应该较快,1min后,A、B的浓度减小,反应速率减慢,则后来1min产生的C小于0.4mol/L,所以平衡时C的浓度小于0.8mol/L;
(3)假设A反应了x,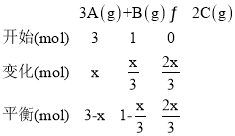 ,根据在容积固定的密闭容器中,容器内气体的压强之比等于它们的物质的量之比,得
,根据在容积固定的密闭容器中,容器内气体的压强之比等于它们的物质的量之比,得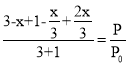 ,解得
,解得![]() ,A的转化率a(A)为
,A的转化率a(A)为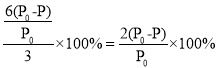 ;
;
(4)①升高温度,能加快反应速率;②容器体积不变,充入隋性气体Ar,则浓度不变,则反应速率不变;③容器压強不变,充入惰性气体Ar,使得体积增大,浓度减小,反应速率减慢;④使用催化剂,能加快反应速率;⑤将容器体积缩小一半,则浓度增大,能加快反应速率;所以能加快反应速率的措施是①④⑤;
(5) A.反应前后,体积不变,由于质量守恒,容器内混合气体的质量始终保持不变,则密度始终保持不变,不能说明该反应达到平衡;
B. 该反应3A(g)+B(g)![]() 2C(g) 是物质的量减少的反应,体积固定,容器内压强与物质的量成正比,则压强可以变化,所以压强保持不变可以说明该反应达到平衡;
2C(g) 是物质的量减少的反应,体积固定,容器内压强与物质的量成正比,则压强可以变化,所以压强保持不变可以说明该反应达到平衡;
C. A、B的起始浓度之比为3:1,两者反应的关系也是3:1,则浓度之比一直保持为3:1,不能说明该反应达到平衡;
D. 单位时间内断开3nmolA-A键是正反应,生成nmolB-B键是逆反应,且符合反应的比例关系,所以可以说明该反应达到平衡;
E. 根据化学方程式中,反应速率之比等于化学计量数之比,则v(A)=3v(B) ,所以不能说明该反应达到平衡;
综上所述选择BD。


科目:高中化学 来源: 题型:
【题目】氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为_______,该能层的原子轨道数有_____ 个。下列有关表示基态氮原子的电子排布图中,仅违背洪特规则的是________(填字母)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)氮的一种氢化物 N2H4 是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4 ℃、113.5 ℃,氨气的熔点、沸点分别为-77.7 ℃、-33.5 ℃。
①N2H4中氮原子的杂化轨道类型为_______杂化。
②H2O的VSEPR模型为______。
③肼与氨气熔点、沸点差异最主要的原因是_________________。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有___________ (填序号)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(4)已知[Co(NH3)6]3+的几何构型为正八面体形,推测[CoCl3(NH3)3]结构有__________种。
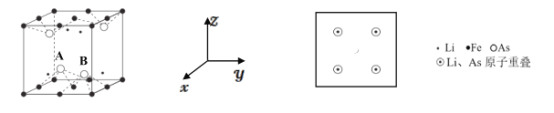
(5)LiFeAs可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为 a nm,A、B 处的两个As原子之间距离=______nm,请在z轴方向投影图中画出铁原子的位置,用“ ”表示__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 在水玻璃溶液中通入少量CO2:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
B. 向0.1L5mol·L-1亚硫酸氢铵溶液中逐滴加入0.1L7mol·L-1 NaOH溶液:2NH![]() +5HSO3-+7OH-===2NH3·H2O+5SO
+5HSO3-+7OH-===2NH3·H2O+5SO![]() +5H2O
+5H2O
C. Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
D. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=AlO2-+2H2O+4NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某恒容密闭容器中进行反应X(g) + 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A. c1:c2 = 1:3
B. 当4v(X)正= v(Y)逆时,该反应还在向正反应方向建立平衡
C. c1可能为0.1
D. X、Y的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将W1g光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2g。实验时由于所伸入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是
A.NaOH溶液,W1=W2B.无水乙醇,W1=W2
C.NaHSO4溶液,W1<W2D.CO,W1>W2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中错误的是
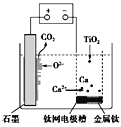
A. 在制备金属钛前后,整套装置中CaO的总量保持不变
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子
D. 若用铅蓄电池作供电电源,“—”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能与银氨溶液反应析出银,如果条件控制适当,析出的银会均匀分布在试管上,形成光亮的银镜,这个反应叫银镜反应。某实验小组对银镜反应产生兴趣,进行了以下实验。
(1)配制银氨溶液时,随着硝酸银溶液滴加到氨水中,观察到先产生灰白色沉淀,而后沉淀消失,形成无色透明的溶液。该过程可能发生的反应有_________
A. AgNO3+NH3·H2O=AgOH↓+NH4NO3 B. AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
C. 2AgOH=Ag2O+H2O D. Ag2O+4NH3·H2O=Ag(NH3)2OH+3H2O
(2)该小组探究乙醛发生银镜反应的最佳条件,部分实验数据如表:
实验 序号 | 银氨溶液/mL | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
4 | 1 | 3 | 50 | 11 | 6 |
请回答下列问题:
①推测当银氨溶液的量为1 mL,乙醛的量为3滴,水浴温度为60℃,反应混合液pH为11时,出现银镜的时间范围是____________________。
②进一步实验还可探索_______________对出现银镜快慢的影响(写一条即可)。
(3)该小组查阅资料发现强碱条件下,加热银氨溶液也可以析出银镜,并做了以下两组实验进行分析证明。已知:Ag(NH3)2++2H2O![]() Ag++2NH3·H2O。
Ag++2NH3·H2O。
装置 | 实验序号 | 试管中的药品 | 现象 |
| 实验Ⅰ | 2 mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
实验Ⅱ | 2 mL银氨溶液和数滴浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |
①两组实验产生的气体相同,该气体化学式为____________,检验该气体可用____________试纸。
②实验Ⅰ的黑色固体中有Ag2O,产生Ag2O的原因是____________。
(4)该小组同学在清洗试管上的银镜时,发现用FeCl3溶液清洗的效果优于Fe2(SO4)3溶液,推测可能的原因是____________,实验室中,我们常选用稀HNO3清洗试管上的银镜,写出Ag与稀HNO3反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期科学家报告了一种直接电化学合成H2O2的方法,装置如图。下列叙述不正确的是( )
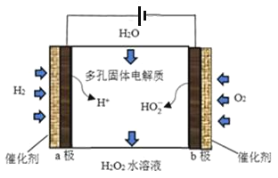
A.该装置的工作原理是将化学能转化成电能
B.b极发生的电极反应为O2+H2O+2e-=HO2-+OH-
C.电池工作时,内部发生反应:HO2-+OH-+2H+=H2O2+H2O
D.电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表信息(部分短周期元素的原子半径及主要化合价)可知,下列叙述正确的是
元素代号 | A | B | C | D | E |
原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
A.离子半径大小:![]()
B.![]() 与
与![]() 的核外电子数不可能相等
的核外电子数不可能相等
C.最高价氧化物对应水化物的碱性:A<C
D.氢化物的稳定性:D>E
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com