
【题目】根据下表信息(部分短周期元素的原子半径及主要化合价)可知,下列叙述正确的是
元素代号 | A | B | C | D | E |
原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
A.离子半径大小:![]()
B.![]() 与
与![]() 的核外电子数不可能相等
的核外电子数不可能相等
C.最高价氧化物对应水化物的碱性:A<C
D.氢化物的稳定性:D>E
【答案】A
【解析】
由元素的化合价可知,D、E都有-2价,处于ⅥA族,E只有-2价,则E为O元素、D为S元素;A化合价为+1价,且原子半径大于D,应为第三周期ⅠA族元素,为Na元素; B只有+3价,原子半径比Na小,比S大,应为Al元素,C为+2价,半径比B小,为Be元素,结合元素周期律分析解答。
根据上述分析,A为Na元素,B为Al元素,C为Be元素,D为S元素,E为O元素。
A.Na+离子比S2-离子少1个电子层,故离子半径:Na +<S2-,故A正确;
B.O2-与![]() 的核外电子数均为10,核外电子数相等,故B错误;
的核外电子数均为10,核外电子数相等,故B错误;
C.金属性越强,最高价氧化物对应水化物的碱性越强,碱性:NaOH>Be(OH)2,即A>C,故C错误;
D.非金属性越强,氢化物越稳定,稳定性:H2O>H2S,即D<E,故D错误;
故选A。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为___________;x为___________。
(2)若反应经2min达到平衡,平衡时C的浓度___________0.8mol/L(填“大于”、“小于”或“等于”)
(3)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0。请用P0、P来表示达平衡时反应物A的转化率a(A)为___________。
(4)能加快反应速率的措施是___________。
①升高温度
②容器体积不变,充入隋性气体Ar
③容器压強不变,充入惰性气体Ar
④使用催化剂
⑤将容器体积缩小一半
(5)能够说明该反应达到平衡的标志是___________。
A. 容器内混合气体的密度保持不变
B. 容器内混合气体的压强保持不变
C. A、B的浓度之比为3:1
D. 单位时间内断开3nmolA-A键的同时生成nmolB-B键
E. v(A)=3v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、E、M、Q、R为七种短周期的主族元素,它们的原子序数依次增大,其中X+无电子,Y、Z同一周期且相邻,X与E、Z与Q分别为同一主族,M的原子序数是Y的2倍,Q的质子数比E多5。J为ds区原子序数最小的元素。请用推断出的元素回答下列问题:
(1)Y、Z、Q三元素的第一电离能由大到小的顺序为__________,Y2 、X2分子中共价键的数目之比为_________,MR4分子的中心原子的杂化轨道类型是_______。
(2)由Q、R两元素可按原子个数比l:l组成化合物T,化合物T中各原子均满足8电子的稳定结构,则T的电子式为________。固体化合物E2Z2投人到化合物E2Q的水溶液中,只观察到有沉淀产生,该反应的离子方程式为______________________。
(3)J元素基态原子的外围电子排布式为___________。向JQZ4溶液中逐滴加人Y元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解得到深蓝色的透明溶液,该沉淀溶解的离子方程式是_____________。
(4)J2Z为半导体材料,在其立方晶胞内部有4个Z原子,其余Z原子位于面心和顶点,则该晶胞中有______个J原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列科普材料并填空。
燃料电池是一种化学电池,具有能量转化率高、对环境友好等优点。例如,氢氧燃料电池在工作时,从负极连续通人①H2,从正极连续通入②O2,二者在电池内部(含有③H2SO4,或④KOH等物质的溶液)发生反应生成⑤H2O,同时产生电能。⑥CH4、⑦C2H5OH等也可以作为燃料电池的燃料。目前还研制成功⑧Al-⑨空气燃料电池,它可以代替汽油为汽车提供动力也可以用作照明电源等。
(1)上述材料涉及到的物质中,属于氧化物的是________(填序号,下同),属于混合物是________。
(2)从物质的类别来看,H2、O2、A1都属于________,包含以上三种物质所含元素的一种两性物质与NaOH溶液反应的离子方程式为________。
(3)已知甲烷燃料电池中发生反应为CH4+2O2=CO2+2H2O,标准状况下每消耗11.2L甲烷,转移的电子数目为________NA。
(4)上述燃料电池发生的反应均为________反应(填“氧化还原”或“非氧化还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)_____________________________________
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是________________________________
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸钾溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
实验步骤 | 预期现象和结论 |
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 | |
步骤2:取适量步骤1所得溶液于试管中 加入少量的____________________溶液。 | 若溶液褪色,说明其有_________若溶液不褪色,说明其中没有______ |
步骤3: 再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴 加___________溶液。 | 如果有白色沉淀生成,则说明其中有_____________,已经变质。 如果没有白色沉淀生成,则说明其中 没有_____________ |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2molL-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入____________,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05molL-1酸性高锰酸钾装入50ml__________(填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数=______________(只列出计算式,不要求算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化:
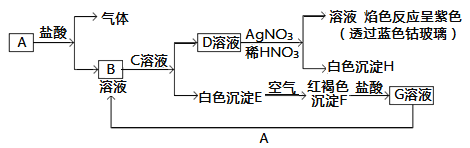
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式________________________。
(3)写出用KSCN鉴别G溶液的离子方程式________________;向G溶液加入A的有关离子反应方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是
A. 当它们的体积和温度、压强均相同时,三种气体的密度ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强p(H2)<p(N2)<p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体V(O2)<V(N2)<V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2 mol O3和3 mol O2的质量之比为___,同温同压下的密度之比为____,含氧原子数之比为____。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g.此混合物中CO和CO2分子数目之比是________,混合气体的平均摩尔质量是________,对氢气的相对密度是________.
(3)下列几种均属烃的含氧衍生物,请按要求作答:
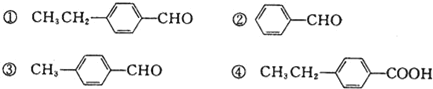
一定条件下①可转化为④,下列试剂中能实现该转化的是_________(填字母).
A.高锰酸钾溶液 B.H2
C.银氨溶液/H+ D.氢氧化钠溶液
(4)已知 :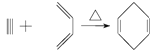 如果要合成
如果要合成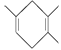 ,所用的起始原料的系统名称为_________________。
,所用的起始原料的系统名称为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种副作用小的新型镇痛消炎药K的合成路线如图所示:
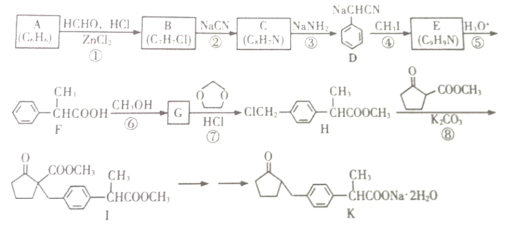
请回答下列问题
(1)F分子中官能团的名称为______________;B分子中处于同一平面的原子最多有____个
(2)反应⑥的条件为_______________;反应⑧的类型为_______________________。
(3)反应⑦除生成H外,另生成一种有机物的结构简式为_______________________。
(4)反应①的化学方程式为_______________________。
(5)符合下列条件的G的同分异构体有_____________种
Ⅰ.苯环上有且仅有四个取代基;
Ⅱ.苯环上的一氯代物只有一种;
Ⅲ.能发生银镜反应。
其中还能发生水解反应的同分异构体的结构简式为______________(只写一种即可)。
(6)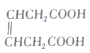 是合成
是合成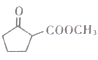 的重要中间体。参照题中合成路线,设计由1,3-丁二烯合成
的重要中间体。参照题中合成路线,设计由1,3-丁二烯合成![]() 的一种合成路线(无机试剂任选):_______________。
的一种合成路线(无机试剂任选):_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com