
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol-1)的变化。

(1)该反应为___(填吸热或放热)反应。
(2)在体积固定的密闭容器中,下列能说明该反应已经达到平衡状态的是___(填序号)。
A.v(H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH)
D.容器内气体密度保持不变
E.2molC=O键断裂的同时CH3OH中有1molH—O键形成
F.混合气体的平均摩尔质量不变
(3)在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=___。达平衡时容器内平衡时与起始时的压强比___。
(4)甲醇、氧气在一定条件下可构成如图3所示的燃料电池,其负极的电极反应为___,与铅蓄电池相比,当消耗相同质量的负极物质时,甲醇燃料电池的理论放电量是铅蓄电池的___倍(保留小数点后1位)。
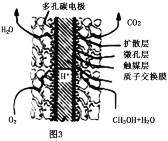
【答案】放热 BCF 0.225mol/(L·min) 5∶8 CH3OH-6e-+H2O=6H++CO2 19.4
【解析】
(1)根据反应物的总能量大于生成物的总能量判断;
(2)根据化学平衡的特征分析判断;
(3)根据三段式结合物质的量比等于压强比计算解答;
(4)甲醇、氧气在酸性条件下可构成燃料电池,负极上甲醇失去电子生成二氧化碳;铅蓄电池中负极材料为Pb,氧化为PbSO4,结合转移的电子数计算甲醇燃料电池的理论放电量与铅蓄电池的倍数。
(1)由图可知,该反应中反应物的总能量大于生成物的总能量,则该反应为放热反应,故答案为:放热;
(2)A.v(H2)=3v(CO2),始终存在,不能判断正、逆反应速率的关系,不能判定平衡状态,故A错误;B.该反应为气体物质的量变化的反应,容器内气体的压强为变量,则容器内气体压强保持不变,说明达到平衡状态,故B正确;C.v逆(CO2)=v正(CH3OH),可知正、逆反应速率相等,说明达到平衡状态,故C正确;D.混合气体的质量、体积不变,则容器内气体密度始终保持不变,不能判定平衡状态,故D错误;E.1molH-O键断裂的同时2molC=O键形成,都表示正反应速率,不能判定平衡状态,故E错误;F.反应前后气体的物质的量发生变化,则混合气体的平均摩尔质量为变量,混合气体的平均摩尔质量不变,说明达到平衡状态,故F正确,故答案为:BCF;
(3)根据三段式:

从反应开始到平衡,用氢气浓度变化表示的平均反应速率为:v(H2)=![]() =0.225mol/(L·min);达平衡时容器内平衡时与起始时的压强之比为
=0.225mol/(L·min);达平衡时容器内平衡时与起始时的压强之比为![]() =5∶8,故答案为:0.225mol/(L·min); 5∶8;
=5∶8,故答案为:0.225mol/(L·min); 5∶8;
(4)甲醇、氧气在酸性条件下可构成燃料电池,负极上甲醇发生氧化反应生成二氧化碳,负极的电极反应式为CH3OH-6e-+H2O=6H++CO2;铅蓄电池中负极材料为Pb,氧化为PbSO4,甲醇燃料电池中负极通入甲醇,氧化生成CO2,相同质量的Pb和甲醇转移的电子数之比为![]() ×2∶
×2∶![]() ×6=32∶621,则甲醇燃料电池的理论放电量是铅蓄电池的
×6=32∶621,则甲醇燃料电池的理论放电量是铅蓄电池的![]() 倍=19.4倍,故答案为:CH3OH-6e-+H2O=6H++CO2;19.4。
倍=19.4倍,故答案为:CH3OH-6e-+H2O=6H++CO2;19.4。


科目:高中化学 来源: 题型:
【题目】利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是

A.H+由阳极区向阴极区迁移
B.阳极电极反应:2HCl + 2e- == Cl2 + 2H+
C.阴极电极反应:Fe3+ + e- == Fe2+
D.阴极区发生的反应有:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为__________________;
(2)等浓度的NaHCO3 、Na2CO3混合溶液中的物料守恒表达式为___________________;
(3) 浓度为0.1mol/LNa2CO3溶液电荷守恒表达式为____________________;
(4) Fe2(SO4)3溶液显酸性,用离子方程式表示其原因____________________;
(5) NaHCO3溶液中粒子浓度由大到小的顺序是______________________________。
(6)常温下,NaHSO3溶液中粒子浓度由大到小的顺序是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活生产、环境密切相关。下列说法错误的是( )
A.苏打和小苏打都是在厨房里常见的物质
B.臭氧和活性炭都可用于有些高级游泳池的消毒
C.司母戊鼎和我国航母飞行甲板的材料都是钢制品
D.![]() 和
和![]() 对大气污染的长期性都与溶液的稳定性有关
对大气污染的长期性都与溶液的稳定性有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾中含有多种污染物,包括氮氧化物![]() 、CO、
、CO、![]() 等。它们可以通过化学反应得到一定的消除或转化。
等。它们可以通过化学反应得到一定的消除或转化。
![]() 氮硫的氧化物的转化:
氮硫的氧化物的转化: ![]()
已知:![]()
![]()
![]() ,则
,则![]() _______
_______![]() 。
。
一定条件下,将![]() 与
与![]() 以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______。
以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有_______。
![]() 混合气体的密度不变
混合气体的密度不变 ![]() 混合气体的颜色保持不变
混合气体的颜色保持不变
![]() 和NO的体积比保持不变
和NO的体积比保持不变 ![]() 反应速率
反应速率![]()
![]() 碳氧化物的转化:
碳氧化物的转化:
![]() 可用于合成甲醇,反应方程式为:
可用于合成甲醇,反应方程式为:![]() ,在一恒温恒容密闭容器中充入
,在一恒温恒容密闭容器中充入![]() 和
和![]() 进行上述反应。测得CO和
进行上述反应。测得CO和![]() 浓度随时间变化如图1所示。
浓度随时间变化如图1所示。

则![]() 内,氢气的反应速率为____
内,氢气的反应速率为____![]() 第
第![]() 后,保持温度不变,向该密闭容器中再充入
后,保持温度不变,向该密闭容器中再充入![]() 和
和![]() ,则平衡_______
,则平衡_______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。
![]() 通过电解CO制备
通过电解CO制备![]() ,电解液为碳酸钠溶液,工作原理如图2所示,写出阴极的电极反应式_____。若以甲醇燃料电池作为电源,则生成标准状况下
,电解液为碳酸钠溶液,工作原理如图2所示,写出阴极的电极反应式_____。若以甲醇燃料电池作为电源,则生成标准状况下![]() 需要消耗
需要消耗![]() 的质量为_______。
的质量为_______。

![]() 硫氧化物的转化:硫的氧化物与一定量氨气、空气反应,可生成硫酸铵。硫酸铵水溶液呈酸性的原因是________________
硫氧化物的转化:硫的氧化物与一定量氨气、空气反应,可生成硫酸铵。硫酸铵水溶液呈酸性的原因是________________![]() 用离子方程式表示
用离子方程式表示![]() 室温时,向
室温时,向![]() 溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:
溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:![]() ____
____![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)开始进行时,c(NH3)=0.04mol/L,经5min后,c(NH3)=0.03mol/L,则v(H2O)为( )
A.0.003mol/(Lmin)B.0.002mol/(Lmin)
C.0.0045mol/(Lmin)D.0.003mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.若将12.8gCu跟足量的浓硝酸反应,铜消耗完时,
(1)产生气体的体积为___(标准状况,不考虑NO2转化成N2O4)。
(2)该反应转移的电子总数为___。
(3)铜与浓硝酸反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com