
【题目】研究人员用H2S废气除去空气中的NOx,装置如图所示。熔融态Ca(HSO4)2为电解质,H+可以在该物质中自由移动,a电极附着Li2S。下列说法错误的是( )
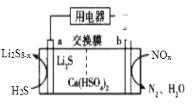
A.电池放电时,电子由电极a经过导线流向电极b
B.电池放电时,H+由质子交换膜右侧向左侧迁移
C.a极应式为(7-x)H2S+Li2S-(14-2x)e-==Li2S8-x+(14-2x)H+
D.若0.1molNO和0.1molNO2组成的混合物在b极参与反应,a极增重9.6g
【答案】B
【解析】
电池放电时,a极上-2价的S化合价升高,变为Li2S8-x,失电子,作负极,则b极作正极。
A.电池放电时,电极a作负极,电极b作正极,电子由负极经过导线流向正极,A说法正确;
B.电池放电时,电池的内电路,H+由质子交换膜向正极移动,即由左侧向右侧移动,B说法错误;
C.a电极硫化氢与硫化锂失电子生成Li2S8-x和氢离子,反应式为(7-x)H2S+Li2S-(14-2x)e-==Li2S8-x+(14-2x)H+,C说法正确;
D.若0.1molNO和0.1molNO2组成的混合物在b极参与反应,转移0.6mol电子,3molH2S参与反应,a极增重3molS的质量即9.6g,D说法正确;
答案为B。


科目:高中化学 来源: 题型:
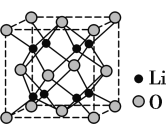
【题目】(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为__________ g·cm-3(列出计算式)。
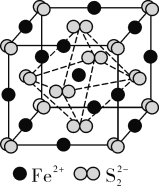
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为________g·cm-3;晶胞中Fe2+位于S![]() 所形成的正八面体的体心,该正八面体的边长为____nm。
所形成的正八面体的体心,该正八面体的边长为____nm。
(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
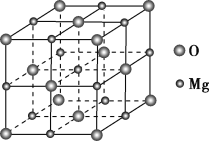
(4)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为____________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用pH传感器探究NaOH溶液与硫酸、硫酸铜混合溶液发生反应的离子反应顺序,绘得三份曲线图如图。已知实验使用的NaOH溶液浓度和滴速相同;硫酸溶液和硫酸铜溶液浓度相同;混合溶液中两溶质的浓度也相同。
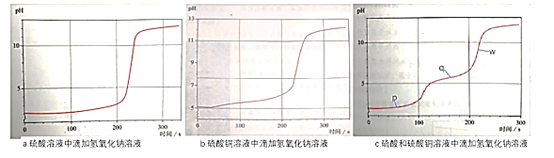
以下解读错误的是
A.三个时点的c(Cu2+):p>q>w
B.w点:c(Na+)>c(SO42-)>c(Cu2+)>c(H+)
C.混合溶液中滴加NaOH溶液,硫酸先于硫酸铜发生反应
D.q点时溶液离子浓度:c(SO42-)+c(OH-)=c(Cu2+)+c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1L0.3mol L1HA溶液与0.1molNaOH固体混合,使之充分反应得到溶液(a)。然后向该溶液中通入HCl或加入NaOH固体(忽略体积和温度变化),溶液pH随通(加)入物质的量的变化如图。下列叙述错误的是

A. HA是一种弱酸
B. 向a点对应溶液中通入HCl,充分反应后,c(H+)/c(HA)增大
C. b点对应溶液中:c(Na+)=c(Cl-)>c(HA)>c(H+)>c(OH-)
D. c点对应溶液中:c(Na+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是_________。
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为_______(用相应的元素符号表示);氮原子的杂化轨道类型为________。

(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______FeO(填“>”“<”或“=”),原因是_________。
(5)NiAs的晶胞结构如图所示:①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为________cm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。请回答:
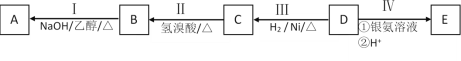
(1)A中所含官能团的名称为___;
(2)Ⅰ的反应类型为___(填字母序号),Ⅲ的反应类型为___;
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(3)D的分子式为___;
(4)写出下列反应的化学方程式:
Ⅰ:___;
Ⅱ:___;
III:C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为___;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,写出其顺式结构的结构简式___;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
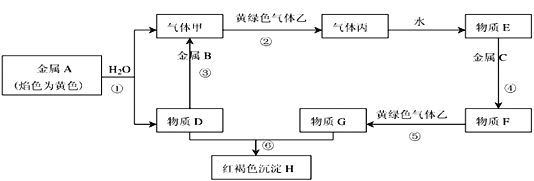
请回答下列问题:
(1)写出下列物质的化学式:丙_________、乙_________。
(2)图中反应①②③④⑤⑥中属于氧化还原反应的有:_____________________ ,属于置换反应反应的有:_______________ 。
(3)写出反应⑤的离子方程式:_____________________;
(4)写出反应①的化学方程式_______________________________ ,当得到标准状况 下的甲气体2.24L,则参加反应的金属A____________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:

①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计实验制备并探究SO2的性质。回答下列问题:
(1)实验室用废铜屑制备SO2的化学方程式为______。
(2)将SO2通入NaHS溶液,溶液中有淡黄色沉淀,说明SO2具有______性。
(3)将SO2通过品红溶液,溶液红色逐渐褪去,将褪色后的溶液微热,又显浅红色,这现象可解释为______。
(4)将SO2通入橙黄色酸性K2Cr2O7溶液,溶液逐渐变为浅绿色,该反应中氧化剂与还原剂的物质的量之比为______。(Cr2O72-被还原为Cr3+)
(5)常温下,改变0.1molL-1H2SO3溶液(SO2水溶液)的pH,溶液中的H2SO3、HSO3-、SO32-的物质的量分数δ(X)[δ(X)= 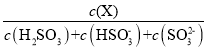 ]随pH的变化如图所示:
]随pH的变化如图所示:
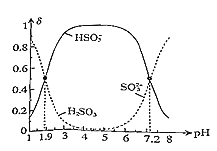
H2SO3的lgKa1=______;反应HSO3-+OH-![]() SO32-+H2O的lgK=______;用0.100molL-1NaOH溶液滴入0.100molL-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为______。
SO32-+H2O的lgK=______;用0.100molL-1NaOH溶液滴入0.100molL-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com