
| A. | 在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性) | |
| B. | 在加热条件下铜与浓硫酸反应(强氧化性、酸性) | |
| C. | 蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性) | |
| D. | 浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色(脱水性) |
分析 A.根据浓硫酸具有吸水性,不具有挥发性来分析;
B.依据反应中硫元素化合价变化判断;
C.根据浓硫酸具有脱水性来分析;
D.浓硫酸具有吸水性,能够吸收晶体中的结晶水.
解答 解:A.浓硫酸具有吸水性,则在空气中敞口久置的浓硫酸,会吸收空气中的水分而使溶液的质量增大,表现的是浓硫酸的吸水性,故A错误;
B.在加热条件下铜与浓硫酸反应生成硫酸铜和二氧化硫和水,硫元素化合价部分变化,体现浓硫酸的强的氧化性和酸性,故B正确;
C.蔗糖与浓硫酸反应中有海绵状的炭生成,体现浓硫酸的脱水性,故C错误;
D.硫酸与少量胆矾晶体混合,晶体由蓝色变成白色,体现浓硫酸的吸水性,故D错误;
故选:B.
点评 本题考查浓硫酸的性质,明确浓硫酸的吸水性、脱水性、强氧化性三大特性是解答本题的关键,注意吸水性与脱水性的区别,题目难度不大.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{288V}$mol/L | B. | $\frac{125a}{36V}$mol/L | C. | $\frac{125a}{18V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
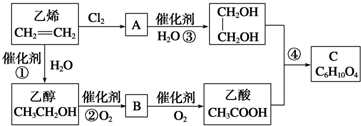
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60能溶于二硫化碳中形成无色透明的溶液,可以用相似相溶原理解释 | |
| B. | 向含有Fe2+的溶液中滴加无色的铁氰化钾溶液,可以观察到蓝色沉淀产生 | |
| C. | 甲烷是空间正四面体结构,四个氢的相对位置完全等效,其任意取代物都不会产生同分异构现象 | |
| D. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
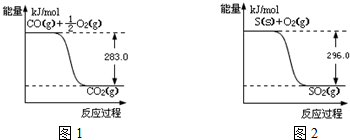
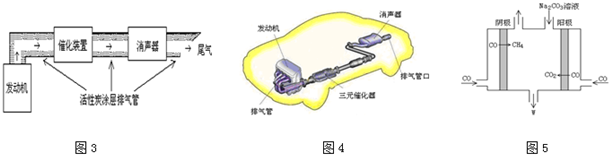
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
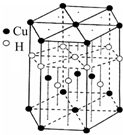 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com