
| 温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
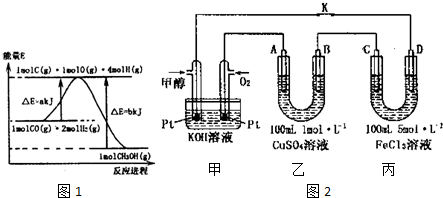
分析 (1)由反应过程中物质能量变化图可知,1molCO(g)与2molH2(g)完全反应生成1molCH3OH(g)放出热量为(b-a)kJ,注明物质的状态书写热化学反应方程式;
(2)①根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CH3OH),再利用速率之比等于其化学计量数之比计算v(H2);
②由表中数据可知,500℃平衡时甲醇为0.8mol/L,利用三段式计算平衡时各组分浓度,代入平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,平衡正向移动,正、逆反应速率均增大,但正反应速率增大更多,据此结合选项分析;
(3)①负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水;
②乙为电解池,A为阳极、B为阴极,A电极生成气体为氧气,B电极先析出Cu,而后生成气体为氢气,根据电子转移守恒计算生成气体的物质的量,进而计算氧气的体积;
③丙为电解池,C为阳极、D为阴极,C用Cu作电极材料,为活性电极,阳极上Cu放电得到铜离子,阴极发生还原反应,溶液中氯离子物质的量不变,要使丙装置中金属阳离子恰好完全沉淀,此时溶液中溶质为NaCl,根据氯离子守恒计算n(NaCl),根据钠离子守恒计算n(NaOH),进而计算NaOH溶液体积.
解答 解:(1)由反应过程中物质能量变化图可知,1molCO(g)与2molH2(g)完全反应生成1molCH3OH(g)放出热量为(b-a)kJ,则热化学反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol,
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol;
(2)①300℃时反应开始10分钟内,甲醇浓度变化量为0.4mol/L,其v(CH3OH)=$\frac{0.4mol/L}{10min}$=0.04mol/(L•min),速率之比等于化学计量数之比,则v(H2)=2v(CH3OH)=0.04mol/(L•min)×2=0.08mol/(L•min),
故答案为:0.08mol/(L•min);
②由表中数据可知,500℃平衡时甲醇为0.8mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):1 2 0
转化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 0.4 0.8
故500℃平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.8}{0.2×0.{4}^{2}}$=25,故答案为:25;
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,平衡正向移动,
a.体积缩小,c(H2)增大,平衡正向移动不能消除氢气浓度增大,故a错误;
b.压强增大,正反应速率加快,逆反应速率也加快,平衡正向移动,正反应速率增大更多,故b错误;
c.平衡正向移动,则CH3OH的物质的量增加,故c正确;
d.平衡正向移动,氢气的物质的量减少,甲醇的物质的量增加,则重新平衡时时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小,故d正确,
故答案为:cd;
(3)①负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②乙为电解池,A为阳极、B为阴极,A电极生成气体为氧气,B电极先析出Cu,而后生成气体为氢气,析出Cu的物质的量为0.1L×1mol/L=0.1mol,设氧气、氢气的物质的量均为n mol,根据电子转移守恒:4n=2n+0.1×2,解得n=0.1,故A极析出的氧气在标准状况下的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
③丙为电解池,C为阳极、D为阴极,C用Cu作电极材料,为活性电极,阳极上Cu放电得到铜离子,阴极发生还原反应,溶液中氯离子物质的量不变,要使丙装置中金属阳离子恰好完全沉淀,此时溶液中溶质为NaCl,根据氯离子守恒n(NaCl)=3n(FeCl3)=3×0.1mol×5mol/L=1.5mol,根据钠离子守恒n(NaOH)=n(NaCl)=1.5mol,故需要NaOH溶液体积为$\frac{1.5mol}{5mol/L}$=0.3L=300mL,
故答案为:300.
点评 本题比较综合,涉及热化学方程式书写、反应速率计算、平衡常数计算、化学平衡移动、电极反应式书写、电化学有关计算等,需要学生具备扎实的基础,(3)中注意利用守恒法计算,避免计算过程的繁琐,较好的考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
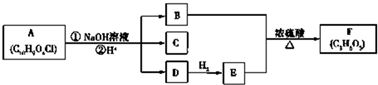
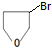 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$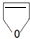 +NaBr+H2O.
+NaBr+H2O.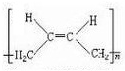 .
.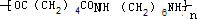 +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
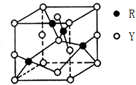 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
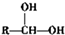 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$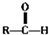 (R为羟基)
(R为羟基) .
. .
.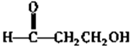 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
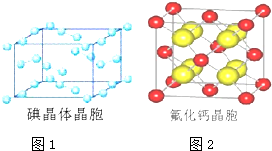
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
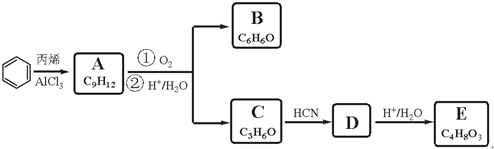
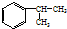 ,A的含有苯环的同分异构体(除A外)有7种.
,A的含有苯环的同分异构体(除A外)有7种.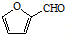 )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式 .
. G:
G: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L Cl2完全溶于氢氧化钠溶液时,转移电子数为NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| C. | 标准状况下,2.24 L NH3中含有共价键的数目为0.3NA | |
| D. | 常温下,22.4 L NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com