
【题目】A——F是中学化学常见的六种物质,它们之间有如下转化关系。

已知A是厨房中常见的一种调味品,D是一种黄绿色气体单质,F是一种黑色固体,F常用作催化剂,回答下列各题:
(1)①②③④四个反应中,属于氧化还原反应的是____________。
(2)写出①③两个化学反应的化学方程式:①____________________________________;③____________________________________。
【答案】①②③ 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ MnO2 +4HCl(浓)
2NaOH+H2↑+Cl2↑ MnO2 +4HCl(浓) ![]() MnCl2 + Cl2↑+2H2O
MnCl2 + Cl2↑+2H2O
【解析】
已知A是厨房中常见的一种调味品,为氯化钠,D是一种黄绿色气体单质,为氯气,F是一种黑色固体, F常用作催化剂,为二氧化锰。据此解答问题。
已知A是厨房中常见的一种调味品,为氯化钠,D是一种黄绿色气体单质,为氯气,F是一种黑色固体, F常用作催化剂,为二氧化锰。则A为氯化钠,B为氢氧化钠,C为氢气,D为氯气,E为氯化氢,F为二氧化锰。(1)有元素化合价变化的反应为氧化还原反应,四个反应中属于氧化还原反应的为①②③。
(2)反应①为电解氯化钠生成氢氧化钠和氢气和氯气,方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
③为浓盐酸和二氧化锰反应生成氯化锰和氯气和水,方程式为:MnO2 +4HCl(浓) ![]() MnCl2 + Cl2↑+2H2O。
MnCl2 + Cl2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
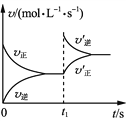
A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:

①检查装置气密性,往三颈烧瓶中依次加入过量锌粉、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)装置甲中连通管a的作用是______________________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为______________________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为______________________。
(4)装置丙中导管口水封的目的是______________________。
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是________(填字母)。
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl3溶液中含溶质3.17 g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是______________________。
(7)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
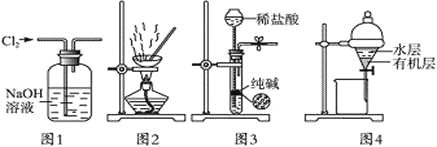
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有重要作用。
( I )下列关于实验的叙述中正确的有______________(填字母)。
A.酒精灯使用结束后,应立即吹灭
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
C.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
D.取用Na2SO4溶液时,发现取量过多,为了不浪费,应把多余的试剂倒入原试剂瓶中
E.称量氢氧化钠固体时,应先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称
F.使用分液漏斗前要检查其是否漏水
G.测量溶液pH时,应先将pH试纸润湿
( II )化学家研究物质的组成和性质时,首先需要将被研究的物质从混合物中分离出来并加以提纯,以下是常见的可用于分离或提纯物质的部分仪器和方法:
仪器:

方法:① 过滤;② 结晶;③ 蒸馏;④ 萃取分液。
请将相应的字母填入空白处:
实验 | 所需仪器 | 方法 |
除去水中混有的泥沙 | _______ | _______ |
从海水中获取淡水 | _______ | _______ |
分离碘和水的混合物 | _______ | _______ |
从海水中获取粗盐 | _______ | _______ |
( III ) 实验室用63%的浓HNO3 (其密度为1.4 g·mL-1)配制480 mL 0.25 mol·L-1稀HNO3;可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.托盘天平 f.10 mL量筒 g.50 mL量筒
回答下列问题:
(1)此浓硝酸的物质的量浓度为________mol·L-1。
(2)量取63%的浓硝酸时应选用________(填仪器的字母编号)量取________mL。
(3)实验时,上述仪器中还需要选用的有_________(填字母),还缺少的仪器有_______、_____ (写仪器名称)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏低的是________________ (填序号)。
①用量筒量取浓硝酸时,眼睛俯视刻度线
②容量瓶使用时底部残留有水
③定容时眼睛俯视刻度线
④移液时不小心有少量液体洒到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A. CO的摩尔质量为28g
B. 1mol·L-1 NaOH溶液中所含有Na+数目为NA
C. 8g NH4NO3中含有0.2mol N原子
D. 0.5mol H2所占的体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“冰→液体水→氢气和氧气”的变化过程中,微粒间被破坏的作用力依次是( )
A.范德华力、范德华力
B.范德华力、共价键
C.共价键、范德华力
D.共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中添加的SO2有抗氧化和杀菌等作用。中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。
I.SO2的制取和部分性质研究。
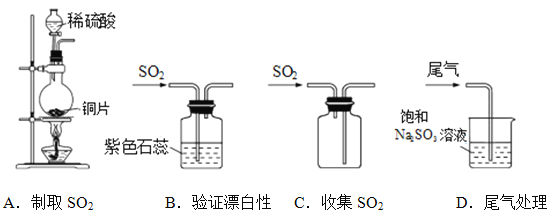
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是____________
(2)设计实验验证SO2与Fe2+ 还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加_________溶液,观察到_____________, 可知混合液中无Fe3+;
向乙中滴加_________溶液,观察到______________,可知混合液中有__________由此得出结论:SO2的还原性强于Fe2+ 。
II.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或HSO3-。设计如图1的实验:
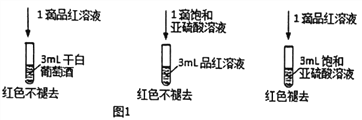
甲同学得出实验结论:干白葡萄酒中不含SO2或HSO3-。这个结论是否合理_____(填“是”或“否”)说明理由__________________________________________。
(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
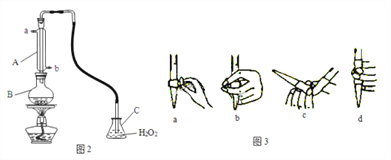
实验步骤:
i. 检查装置的气密性后,向图2仪器B中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与C中H2O2完全反应
iii. 除去C中过量的H2O2
iv. 用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
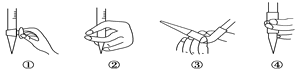
①仪器A的名称是____,A的进水口为____,滴定前排气泡时,应选择图3中的___。
②C中反应生成物的化学式是________,除去过量H2O2的方法是_________________。
③滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为____g/L,是否符合国家标准________(填“是”或“否”)。
④下列操作使测定结果比实际值偏高的是______________。
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中的SO2,并对含量进行测定。实验步骤如下
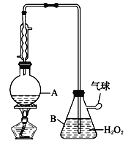
i. 检查装置的气密性后,向仪器A中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与B中H2O2完全反应
iii. 除去B中过量的H2O2后,将B中溶液取出,稀释至100mL
iv.取25.00mL 稀释后的溶液至于锥形瓶中,加入几滴酚酞
v.用0.0300mol/L NaOH标准溶液进行滴定,重复三次
(1)SO2在水中可形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用化学方程式表示为_______________。
(2)图中①中仪器名称为_____________,步骤v中,滴定前排气泡时,应选择图中的___。
(3)除去过量H2O2的方法是_________________。
(4)滴定的终点现象_____________________________________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)___________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(5)滴定消耗的NaOH溶液的体积如下,则该葡萄酒中SO2含量为____g/L。
滴定次数 | 1 | 2 | 3 |
NaOH溶液体积/mL | 21.80 | 20.02 | 19.98 |
(6)某同学认为该测定结果不能说明该葡萄酒中SO2残留量一定超标。原因是__________。利用现有装置可以如何改进?_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com