
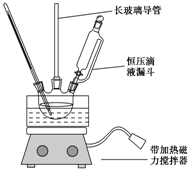
 硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
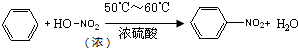 .
.分析 (1)苯能与硝酸发生取代反应,苯环上的一个氢原子被硝基取代,得到硝基苯和水;
(2)浓硫酸与浓硝酸混合放出大量的热,配制混酸应将浓硫酸中注入浓硝酸中,及时搅拌、冷却,防止溅出伤人;苯、浓硝酸沸点低,易挥发,长玻璃管能冷凝回流挥发的苯、浓硝酸;恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下;
(3)温度过高有副反应发生,具有苦杏仁味的硝基苯的密度比水大,分离互不相溶的液态,采取分液操作;
(4)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(5)反应得到粗产品中有残留的硝酸及硫酸,需要除去,用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤,未洗净晶体表面含有碳酸根离子,检验最后一次洗涤液即可;
(6)要得到纯净的硝基苯,粗产品依次用蒸馏水、10%Na2CO3溶液洗涤,再用蒸馏水洗涤,最后用无水CaCl2干燥、蒸馏,从而得到纯硝基苯.
解答 解:(1)苯环上的一个氢原子能与硝酸中的硝基发生取代反应得到硝基苯,所以由苯制取硝基苯的化学方程式是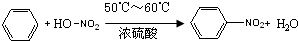 ,
,
故答案为: ;
;
(2)浓硫酸密度大于浓硝酸,浓硫酸与浓硝酸混合放出大量的热,所以配制一定比例浓硝酸和浓硫酸混合酸时:先将浓硝酸注入烧杯中,再慢慢注入浓硫酸,并及时搅拌和冷却,长玻璃管作用是导气、冷凝回流,该实验中可以冷凝回流挥发的浓硝酸以及苯使之充分反应,减少反应物的损失,提高转化率,和普通分液漏斗相比,恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,
故答案为:浓硝酸;冷凝回流;使混合酸能顺利流下;
(3)浓硝酸和浓硫酸是强腐蚀性酸,且具有强氧化性,温度不能过高控制在50~60℃,防止副反应发生,硝基苯是油状液体,与水不互溶,密度比水大,在下层,分离互不相溶的液态,采取分液操作,
故答案为:防止副反应发生;下;分液;
(4)配制100mL 0.1mol/L的Na2CO3溶液,配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量碳酸钠固体,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,需要用到的玻璃仪器除了玻璃棒、烧杯还有100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(5)反应得到粗产品中有残留的硝酸及硫酸,用10%Na2CO3溶液洗涤除去粗产品中残留的酸,之后再用蒸馏水洗涤,如果晶体未洗净含有碳酸根离子,取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净,
故答案为:取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净;
(6)用蒸馏水洗涤,硝基苯中含有水,用无水CaCl2干燥,然后将较纯的硝基苯进行蒸馏,得到纯硝基苯,
故答案为:氯化钙.
点评 本题主要考查硝基苯的制取、物质的分离方法等知识点,题目难度中等,为高考的高频题,试题综合性较强,知识点较全面,正确理解制备原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质的分子式为C3H8O | |
| B. | 分子中共有6种化学环境不同的氢原子 | |
| C. | 该有机物的结构简式为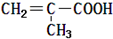 | |
| D. | 该有机物可能与新制的氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
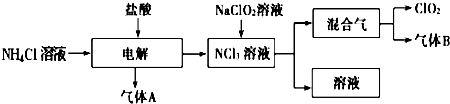
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用图中的实验装置制取乙炔.
用图中的实验装置制取乙炔. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
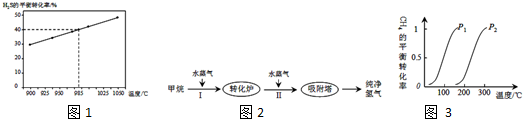
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

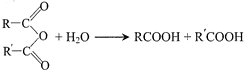
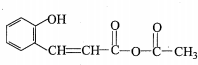 ,G
,G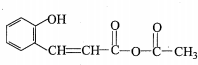

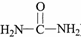 )氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式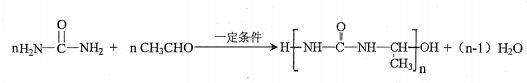
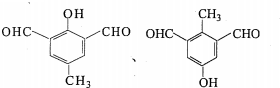 任意一种.
任意一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com