
分析 (1)根据盖斯定律计算反应热,①2CO(g)+O2(g)═2CO2(g)△H1kJ•mol-1
②2H2(g)+O2(g)═2H2O(g)△H2kJ•mol-1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3kJ•mol-1
则将方程式$\frac{①+2②-③}{2}$得所需热化学方程式;
(2)平衡时容器中c(CO)=$\frac{10mol×(1-40%)}{2L}$=3mol/L,根据CO(g)+2H2(g)?CH3OH(g)知,c(H2)=$\frac{20mol-10mol×40%×2}{2L}$=6mol/L,c(CH3OH)=$\frac{10mol×40%}{2L}$=2mol/L,根据平衡常数公式计算其平衡常数;根据浓度商与平衡常数相对大小判断反应移动方向,从而确定CO物质的量分数变化;
(3)①甲酸钠是强碱弱酸盐,甲酸根离子水解导致甲酸钠溶液呈碱性;
水解平衡常数K=$\frac{c(O{H}^{-})c(HCOOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{Kw}{Ka}$,据此计算c(OH-)及溶液的pH;
②向20ml 0.1mol/L的甲酸钠溶液中小心滴加10ml 0.1mol/L的盐酸,溶液中溶质为等物质的量浓度甲酸钠、甲酸和NaCl,混合液呈酸性,说明甲酸电离程度大于甲酸根离子水解程度,结合电荷守恒判断离子浓度大小.
解答 解:(1)①2CO(g)+O2(g)═2CO2(g)△H1kJ•mol-1
②2H2(g)+O2(g)═2H2O(g)△H2kJ•mol-1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3kJ•mol-1
则将方程式$\frac{①+2②-③}{2}$得CO(g)+2H2(g)?CH3OH(g)△H=$\frac{△{H}_{1}+2{H}_{2}-△{H}_{3}}{2}$,
故答案为:$\frac{△{H}_{1}+2{H}_{2}-△{H}_{3}}{2}$;
(2)平衡时容器中c(CO)=$\frac{10mol×(1-40%)}{2L}$=3mol/L,根据CO(g)+2H2(g)?CH3OH(g)知,c(H2)=$\frac{20mol-10mol×40%×2}{2L}$=6mol/L,c(CH3OH)=$\frac{10mol×40%}{2L}$=2mol/L,化学平衡常数K=$\frac{2}{3×{6}^{2}}$=1.85×10-2;
加入这些物质时c(CO)=3mol/L+$\frac{10ml}{2L}$=8mol/L,c(H2)=6mol/L+$\frac{20ml}{2L}$=16mol/L,c(CH3OH)=2mol/L+$\frac{10ml}{2L}$=7mol/L,浓度商=$\frac{7}{8×1{6}^{2}}$=0.0034<K,则平衡正向移动,导致CO的物质的量分数减小,
故答案为:1.85×10-2;正向移动;减小;
(3)①甲酸钠是强碱弱酸盐,甲酸根离子水解导致甲酸钠溶液呈碱性,水解方程式为HCOO-+H2O?HCOOH+OH-;
水解平衡常数K=$\frac{c(O{H}^{-})c(HCOOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{Kw}{Ka}$,c(OH-)=$\sqrt{\frac{1{0}^{-14}×0.1}{1.7×1{0}^{-4}}}$mol/L,c(H+)=$\frac{1{0}^{-14}}{\sqrt{\frac{1{0}^{-14}×0.1}{1.7×1{0}^{-4}}}}$,溶液的pH=-lg$\frac{1{0}^{-14}}{\sqrt{\frac{1{0}^{-14}×0.1}{1.7×1{0}^{-4}}}}$=8.4,
故答案为:HCOO-+H2O?HCOOH+OH-;8.4;
②向20ml 0.1mol/L的甲酸钠溶液中小心滴加10ml 0.1mol/L的盐酸,溶液中溶质为等物质的量浓度甲酸钠、甲酸和NaCl,混合液呈酸性,C(H+)>C(OH-),说明甲酸电离程度大于甲酸根离子水解程度,结合电荷守恒判断离子浓度大小顺序为C(Na+)>C(HCOO-)>C(Cl-)>C(H+)>C(OH-),
故答案为:C(Na+)>C(HCOO-)>C(Cl-)>C(H+)>C(OH-).
点评 本题考查较综合,涉及离子浓度大小比较、溶液pH计算、化学平衡时计算、盖斯定律等知识点,综合性较强,侧重考查学生分析计算能力,注意三段式法的灵活运用,难点是盐类水解中pH的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )| A. | 该原电池的总反应式为2Fe3++Cu=Cu2++2Fe2+ | |
| B. | 该电池工作时,盐桥中K+向石墨电极定向移动 | |
| C. | 若用此电池电解饱和食盐水制取Cl2,当铜电极的质量减少6.4g时,产生氯气的体积为2.24 L | |
| D. | 电池工作过程中,电子由铜电极经过电流表流向石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
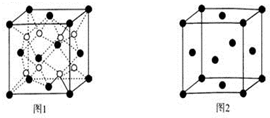
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
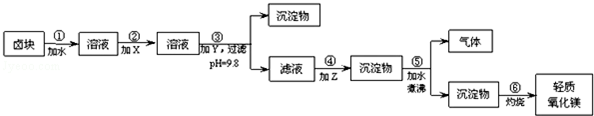
| 物质 | 价格/元•吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者的质量数不同 | B. | 两者的中子数不同 | ||
| C. | 两者的核外电子数相同 | D. | 两者互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| B. | 红葡萄酒营养丰富(含葡萄糖、维生素C等),常添加微量的二氧化硫,利用二氧化硫还原性,防止红葡萄酒中某营养成分被氧化 | |
| C. | 某雨水放置一段时间后pH由4.68变为4.28,因为水中亚硫酸被空气中氧气氧化成硫酸 | |
| D. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
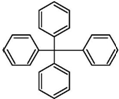 甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子不可能共平面 | |
| C. | 该物质光照下可和氯气发生反应 | |
| D. | 该物质在Fe粉催化下可和液溴发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
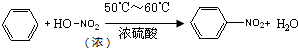
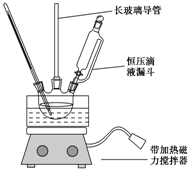 硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:
硝基苯是重要的化工原料,用途广泛.实验室用如图装置制备硝基苯,步骤如下:| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com