考点:位置结构性质的相互关系应用,原电池和电解池的工作原理,难溶电解质的溶解平衡及沉淀转化的本质,物质分离和提纯的方法和基本操作综合应用
专题:
分析:由短周期元素A、B、C、D在周期表中的位置可知,A、B处于第二周期,C、D处于第三周期,B、D最外层电子数之和为12,二者同主族,故最外层电子数为6,则B为O元素,D为S元素,二者可以形成SO
2、SO
3两种分子,且SO
2具有漂白性,由位置关系可知,A为N元素,C为Si元素.
(1)A的氢化物为NH
3,分子中N原子与H原子之间形成1对共用电子对;
(2)非金属性越强,最高价氧化物对应水化物的酸性越强,根据强酸制备弱酸的反应分析解答;
(3)同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号);
(4)由工艺流程图可知,原电池原理为SO
2+Br
2+2H
2O=H
2SO
4+2HBr,分离出硫酸,再电解:2HBr
H
2↑+Br
2,获得氢气,电解得到的溴循环利用.
①分离完全,硫酸中不含HBr,加入AgNO
3溶液,根据沉淀颜色判断
②在原电池中,负极发生氧化反应,SO
2在负极放电生成H
2SO
4;
③在电解过程中,电解槽阴极发生还原反应,电极反应式为2H
++2e-=H
2↑,氢离子浓度降低;
④原电池总反应为与电解池总反应相加可得该工艺流程用总反应的化学方程式;该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,缺点是:生成过程有有毒物质,电解循环消耗能源大;
(5)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br
-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br
-和BrO
3-,同时生成HCO
3-或CO
2;
(6)①升高温度,平衡向正反应方向移动,气体物质的量增大;
②积增大一倍时,P(Br
2)降为原来的一半,减压使平衡向气体体积数增大的方向移动,压强又增大,若反应物足量,平衡恢复到原有的压强.
解答:
解:由短周期元素A、B、C、D在周期表中的位置可知,A、B处于第二周期,C、D处于第三周期,B、D同种主族,B、D最外层电子数之和为12,故最外层电子数为6,故B为O元素,D为S元素,二者可以形成SO
2、SO
3两种分子,且SO
2具有漂白性,由位置关系可知,A为N元素,C为Si元素,
(1)A为N元素,其氢化物为NH
3,氮原子与氢原子之间形成1对共用电子对,电子式为
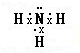
,
故答案为:
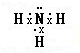
;
(2)非金属性越强,最高价氧化物对应水化物的酸性越强,反应H
2SO
4+Na
2SiO
3=H
2SiO
3↓+Na
2SO
4,可以证明非金属性S>Si,
故答案为:H
2SO
4+Na
2SiO
3=H
2SiO
3↓+Na
2SO
4;
(3)Se与O元素同族元素,同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号),故生成1mol硒化氢(H
2Se)反应热应排在第二位,应为+29.7kJ?mol
-1,
故答案为:b.
(4)由工艺流程图可知,原电池原理为SO
2+Br
2+2H
2O=H
2SO
4+2HBr,分离出硫酸,再电解:2HBr
H
2↑+Br
2,获得氢气,电解得到的溴循环利用.
①分离后的H
2SO
4溶液于试管,向其中逐滴加入AgNO
3溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
②在原电池中,负极发生氧化反应,SO
2在负极放电生成H
2SO
4,电极反应式为SO
2+2H
2O-2e
-=4H
++SO
42-,
故答案为:SO
2+2H
2O-2e
-=4H
++SO
42-;
③在电解过程中,电解槽阴极发生还原反应,电极反应式为2H
++2e
-=H
2↑,氢离子浓度降低,溶液pH变大,
故答案为:变大;
④原电池中电池总反应为SO
2+Br
2+2H
2O=H
2SO
4+2HBr,电解池中总反应为2HBr=H
2+Br
2,故该工艺流程用总反应的化学方程式表示为:SO
2+2H
2O=H
2SO
4+H
2,该生产工艺的优点:溴可以循环利用,获得清洁能源氢气.缺点是:生成过程有有毒物质,电解循环能源消耗大,
故答案为:SO
2+2H
2O=H
2SO
4+H
2;溴可以循环利用,获得清洁能源氢气;生成过程有有毒物质,电解循环能源消耗大;
(5)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br
-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴在碳酸钠溶液的歧化可把反应理解为溴与水发生歧化,产生H
+的被碳酸钠吸收,反应的离子方程式为3:Br
2+6 CO
32-+3H
2O=5 Br
-+BrO
3-+6HCO
3-(或3 Br
2+3CO
32-=5 Br
-+BrO
3-+3CO
2↑),
故答案为:Cl
2;3 Br
2+6 CO
32-+3H
2O=5 Br
-+BrO
3-+6HCO
3-(或3 Br
2+3CO
32-=5 Br
-+BrO
3-+3CO
2↑);
(6)①升高温度,平衡向吸热反应方向移动,气体的物质的量增大,因而可提高P(Br
2),故答案为:增大;
②体积增大一倍时,P(Br
2)降为原来的一半,即2.33×10
3Pa,减压使平衡向气体体积数增大的方向移动,因而会大于2.33×10
3Pa;若反应物足量,可平衡恢复到原有的P(Br
2),
故答案为:2.33×10
3Pa<P(Br
2)≤4.66×10
3Pa.
点评:本题综合较大,涉及元素推断、化学工艺流程、反应热、原电池及电解原理、海水提取溴、化学平衡移动等,侧重于学生的分析能力的考查,难度较大,注意基础知识的全面掌握.


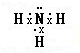 ,
,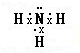 ;
;

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
 已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大.X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:
已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大.X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题: