
| 元素代号 | 部分特征 |
| A | 气态单质在标准状况下密度是0.0893g/L |
| B | 形成的化合物的种类最多 |
| C | 形成的氧化物的种类最多 |
| D | 形成的化合物焰色反应呈黄色 |
| E | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
| F | 最高价氧化物对应的水化物酸性在短周期中最强 |
 ,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.
,该物质能与水剧烈反应生成两种气体,写出其反应的化学方程式NH4H=NH3↑+H2↑.分析 A元素气态单质在标准状况下密度是0.0893g/L,则其摩尔质量=0.0893g/L×22.4L/mol=2g/mol,则A为H元素;B元素形成的化合物的种类最多,则B为碳元素;C元素形成的氧化物的种类最多,则C为N元素;D形成的化合物焰色反应呈黄色,则D为Na;E是生活中常用的金属,在空气中表面通常形成一层致密的氧化膜,则E为Al;F元素最高价氧化物对应的水化物酸性在短周期中最强,则F为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(2)该原子符号为AZX,左下角Z为质子数,左上角A为质量数,X为元素符号,其中质量数=质子数+中子数;
(3)根据盖斯定律,利用方程式乘以合适的系数进行加减构造目标热化学方程式;
(4)H与N形成离子化合物H5N,既含离子键又含共价键,应为NH4H,该物质能与水剧烈反应生成两种气体,实质发生水解反应生成氨气与氢气;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠、氢气;高氯酸与氢氧化铝发生中和反应.
解答 解:A元素气态单质在标准状况下密度是0.0893g/L,则其摩尔质量=0.0893g/L×22.4L/mol=2g/mol,则A为H元素;B元素形成的化合物的种类最多,则B为碳元素;C元素形成的氧化物的种类最多,则C为N元素;D形成的化合物焰色反应呈黄色,则D为Na;E是生活中常用的金属,在空气中表面通常形成一层致密的氧化膜,则E为Al;F元素最高价氧化物对应的水化物酸性在短周期中最强,则F为Cl,
(1)N3-、Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->Na+>Al3+,
故答案为:N3->Na+>Al3+;
(2)B为碳元素,其带8个中子的核素的质量数=6+8=14,则该原子符号为146C,
故答案为:146C;
(3)已知:①N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
②N2H4(g)+O2 (g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1
根据盖斯定律,②×2-①得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1;
(4)H与N形成离子化合物H5N,既含离子键又含共价键,应为NH4H,其电子式为  ,该物质能与水剧烈反应生成两种气体,实质发生水解反应生成氨气与氢气,反应的化学方程式:NH4H=NH3↑+H2↑;
,该物质能与水剧烈反应生成两种气体,实质发生水解反应生成氨气与氢气,反应的化学方程式:NH4H=NH3↑+H2↑;
故答案为: ;NH4H=NH3↑+H2↑;
;NH4H=NH3↑+H2↑;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠、氢气,其反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,高氯酸与氢氧化铝反应的离子方程式为:3H++Al(OH)3=Al3++3H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;3H++Al(OH)3=Al3++3H2O.
点评 本题考查结构性质位置关系应用,明确元素种类是关键,题目侧重对化学用语与元素化合物知识的考查,需要学生具备扎实的基础,(4)为易错点,注意电子式中氢负离子的2个电子为成对电子,不能拆开,根据盐类水解理解氢化铵与水的反应.


科目:高中化学 来源: 题型:实验题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);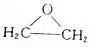 ,写出D和H2O反应生成E的化学方程式
,写出D和H2O反应生成E的化学方程式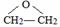 +H2O$\stackrel{一定条件}{→}$HOCH2CH2OH;
+H2O$\stackrel{一定条件}{→}$HOCH2CH2OH; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 图(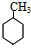 )的一氯代物有4种 )的一氯代物有4种 | |
| B. | 表示甲烷分子或四氯化碳分子的比例模型 | |
| C. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
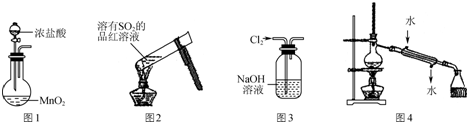
| A. | 实验室用图1装置制备Cl2 | |
| B. | 加热后图2中溶液颜色恢复红色 | |
| C. | 用图3装置除去Cl2中含有的少量HCl | |
| D. | 实验室用图4装置制取少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | COS分子是含有极性键的极性分子 | |
| B. | COS属于离子化合物 | |
| C. | COS的结构式为S=C=O | |
| D. | COS分子中所有原子都满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有毒,不可以作消毒剂和防腐剂 | |
| B. | 橙色的K2Cr2O7酸性水溶液遇到乙醇迅速生成蓝绿色Cr3+是由于乙醇有还原性 | |
| C. | 所有卤代烃均可以发生消去反应和水解反应 | |
| D. | 用食醋去除水壶中的水垢时所发生的是水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含质子数一定为16NA | |
| B. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| C. | 常温下,5.6 g铁与硝酸反应,失去的电子数一定为0.3 NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com