

| 一定条件下 |
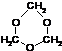 ,故答案为:
,故答案为: ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、该一元酸溶液的pH=1 | ||
| B、该溶液中HA的电离度为1% | ||
| C、该溶液中水的离子积常数为1×10-22 | ||
D、若加水稀释,则
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水.| 阳离子 | Na+ Al3+Fe3+ Cu2+ Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有甲、乙、丙、A、B、C六种物质,其中甲、乙、丙是由短周期元素组成的单质.一定条件下转化关系如图所示:
现有甲、乙、丙、A、B、C六种物质,其中甲、乙、丙是由短周期元素组成的单质.一定条件下转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属镁与稀盐酸反应:有气泡逸出:Mg+2H++2Cl-═MgCl2+H2↑ |
| B、氯化钡溶液与稀硫酸反应:有白色沉淀生成:Ba2++SO42-═BaSO4↓ |
| C、碳酸钠与盐酸反应:有气泡逸出:Na2CO3+2H+═CO2↑+H2O+2Na+ |
| D、硫酸铜溶液中加入过量的NaOH溶液:有白色沉淀产生:Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酒精灯在桌上倾倒失火后,立即用水冲 |
| B、金属钠着火,用泡沫灭火器扑灭 |
| C、点燃甲烷、乙烯等可燃性气体前必须先检验其纯度 |
| D、皮肤上沾上浓硫酸,立即用氢氧化钠溶液冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com