
分析 (1)硅元素是14号元素,原子核外有三个电子层,最外层为4个电子;
(2)a.铅与碳是同族元素,最外层电子数为4,主要化合价为+2、+4;
b.铅是金属不是半导体材料;
c.同主族最高价氧化物对应水化物形成的酸性减弱;
d.同主族从上到下金属性增强,形成最高价氢氧化物的碱性增强;
e.同族的Ge(锗)与盐酸反应,Pb与盐酸能反应,原子半径从上到下依次增大;
(3)碳能与二氧化硅反应生成硅单质;
(4)PbO和次氯酸钠反应生成二氧化铅和氯化钠;
(5)样品失重失去的为氧元素,根据原子守恒求O原子和Pb原子的比值.
解答 解:(1)硅元素是14号元素,原子核外有三个电子层,最外层为4个电子,位于周期表的第三周期第ⅣA族,
故答案为:第三周期;第ⅣA;
(2)a.铅与碳是同族元素,最外层电子数为4,主要化合价为+2、+4,故a正确;
b.同族的Si与Ge(锗)均为半导体材料,铅是金属不是半导体材料,故b错误;
c.同主族最高价氧化物对应水化物形成的酸性减弱,铅的最高价氧化物对应水化物的酸性弱于碳酸,故c错误;
d.同主族从上到下金属性增强,形成最高价氢氧化物的碱性增强,与同族的Ge(锗)作比较:碱性Ge(OH)4<Pb(OH)4,则金属性Ge<Pb,周期表中位置Pb在Ge下面,故d正确;
e.同族的Ge(锗)与盐酸反应,Pb与盐酸能反应,则原子半径Ge<Pb,故e错误;
故答案为:ad;
(3)碳能与二氧化硅反应生成硅单质,化学反应方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO-=PbO2+Cl-,
故答案为:PbO+ClO-=PbO2+Cl-;
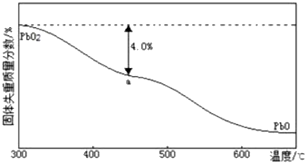
(5)若a点固体组成表示为PbOx,根据PbO2$\frac{\underline{\;\;△\;\;}}{\;}$PbOx+$\frac{2-x}{2}$O2↑,
$\frac{2-x}{2}$×32=239×4.0%,x=1.4;
若组成为mPbO2•nPbO,根据原子守恒得,O原子和Pb原子的比值=$\frac{2m+n}{m+n}$=1.4,得m:n=2:3,
答:x值为1.4;m:n值为2:3.
点评 本题考查碳族元素性质,题目难度中等,涉及物质的量的有关计算、化学方程式和离子方程式书写等知识点,注意同主族递变规律和化学式的计算,掌握基础是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化剂本身被还原,生成氧化产物 | |
| B. | 氧化剂是在反应中得到电子(或电子对偏向)的物质 | |
| C. | 还原剂在反应时所含元素的化合价降低 | |
| D. | 在一个反应中,氧化剂和还原剂不可能是同一物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢气体溶于水 | B. | 白磷在一定条件下转化为红磷 | ||
| C. | 碘在加热条件下升华 | D. | 氯化钠晶体加热熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 0.5 mol/L | C. | 0.6 mol/L | D. | 0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量等于其相对原子质量或相对分子质量 | |
| B. | 摩尔是7个基本物理量之一 | |
| C. | 1molOH-的质量是17g | |
| D. | 1mol气体所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有化合价变化的化学反应一定是氧化还原反应 | |
| B. | 离子反应方程式比化学方程式更能描述化学反应的本质 | |
| C. | 钠能和水反应置换出氢气,也能和硫酸铜溶液反应置换出铜 | |
| D. | 有单质参加的化合反应和有单质生成的分解反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
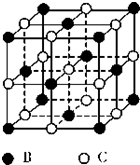 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均不大于30).A的基态原子2p能级有3个单电子;C的核外没有成单电子,B、C两元素形成的化合物晶胞结构如图所示;D的3p能级有1个单电子,且与B所在主族相邻;E元 素在地壳中含量居第四位;则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均不大于30).A的基态原子2p能级有3个单电子;C的核外没有成单电子,B、C两元素形成的化合物晶胞结构如图所示;D的3p能级有1个单电子,且与B所在主族相邻;E元 素在地壳中含量居第四位;则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com