
【题目】键线结构式是以线表示共价键,每个折点和线端点处表示一个碳原子,并省略书写氢原子的一种表示有机化合物结构的方式,如异丁烷(![]() )要表示为“
)要表示为“![]() ”,请分析这一表示方式的要领,试用键线结构式写出戊烷(C5H12)的同分异体____、___、___。
”,请分析这一表示方式的要领,试用键线结构式写出戊烷(C5H12)的同分异体____、___、___。
通过解题你是如何筛选并运用信息的 ______
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物貭的量之向的关系如图所示。则下列説法正确的是( )

A. 溶液中的阳离子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中一定不含CO32-和NO3-,一定含有SO42-
C. 溶液中C(NH4+)=0.2mol/L
D. c(H+):c(Al3+):c(Mg2+)=l:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___________。
(2)写出天然橡胶单体(2-甲基-1,3-丁二烯)的结构简式_________。
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③ (CH3)3CH ④ (CH3)2CHCH2CH3
A.②④①③ B. ④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是_________;互为同分异构体的是______________;属于同种物质的是_____________。
①H2O和D2O ②1H、2H、3H
③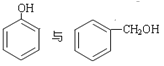 ④
④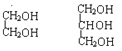
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦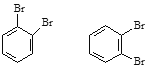
查看答案和解析>>
科目:高中化学 来源: 题型:
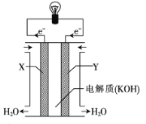
【题目】I.化学电池在通讯、交通及日常生活中有着广泛的应用。
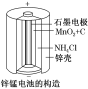
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是__,负极发生的电极反应式为_____。若反应消耗16.25 g负极材料,则电池中转移电子的物质的量为____mol。
(2)目前常用的镍(Ni)镉(Cd)电池的电池总反应式可以表示为2Ni(OH)2+Cd(OH)2![]() Cd+2NiO(OH)+2H2O,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是________。
Cd+2NiO(OH)+2H2O,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是________。
A.NiO(OH)作负极 B.放电时化学能转变为电能
C.Cd作负极 D.此电池是一次电池
(3)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的___(填“正”或“负”)极,X极的电极反应式为____。
II.工业合成氨的反应N2+3H2![]() 2NH3的能量变化如下图所示,请回答有关问题:
2NH3的能量变化如下图所示,请回答有关问题:
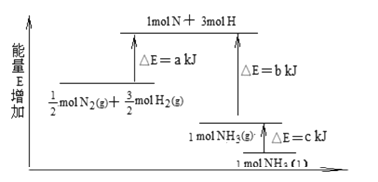
已知:拆开 lmol H—H 键、lmol N-H 键、lmol N≡N 键分别需要的能量是436kJ、391kJ、946kJ。
(1)则上图中的 a=___kJ;1 mol N2(g) 完全反应生成NH3(g)需要___(填“吸收”、“放出”)____kJ热量。
(2)推测反应 2NH3(l)![]() N2 (g)+3H2(g) 比反应2NH3(g)
N2 (g)+3H2(g) 比反应2NH3(g)![]() N2 (g)+3H2(g)______(填“吸收”、“放出”)的热量____(填“多”、“少”)。
N2 (g)+3H2(g)______(填“吸收”、“放出”)的热量____(填“多”、“少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。
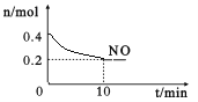
①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
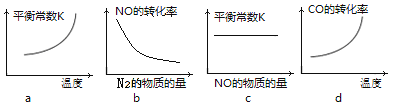
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中选择合适的物质的序号填空:①苯②乙醇③乙酸④乙酸乙酯。
(1)在加热有铜作催化剂的条件下,被氧化后的产物能发生银镜反应的是____;该催化氧化反应的化学方程式为______________________。
(2)在浓硫酸和加热条件下,能发生酯化反应的是_______________________;
(3)既能发生加成反应又能发生取代反应的是____;
(4)在无机酸或碱作用下,能发生水解反应的是____;写出其在碱性条件下水解的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是香荚兰豆的香气成分中含有的物质,其结构简式为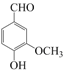 。
。
(1)香草醛含有的含氧官能团有羟基和_______。
(2)香草醛与足量Na2CO3溶液反应的化学方程式为_____________。
(3)香草醛与新制Cu(OH)2反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在NaCl溶液中滴加AgNO3溶液,现象为_____________________________ , 离子方程式为:_________________________________________________
(2)在CH3CH2CH2Cl中滴加AgNO3溶液,现象为_____________________________,原因是__________________________
(3)若先将CH3CH2CH2Cl与NaOH溶液共热,然后用硝酸酸化,再滴加AgNO3溶液,现象为_______________________________________________________,反应的化学方程式为:________________________,______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布式为________。第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有___________(填标号)。
A.都属于p区主族元素B.电负性都比镁大
C.第一电离能都比镁大D.氯化物的水溶液pH均小于7
(3)Al元素可形成[AlF6]3-、[AlCl4]-配离子,而B元素只能形成[BF4]-配离子,由此可知决定配合物中配位数多少的因素是________________;[AlCl4]-的立体构型名称为______。
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是________________
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_________。

A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)F2中F-F键的键能(157kJ/mol)小于Cl2中Cl-Cl键的键能(242.7kJ/mol),原因是_________。
(6)金属钾的晶胞结构如图。若该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,则表示K原子半径的计算式为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com